서 론
유산균(lactic acid bacteria, LAB)은 자연계에 널리 분포하며, 안전한 미생물(generally recognized as safe, GRAS)로 그람 양성, 무포자형성, 구균 또는 간균, 탄수화물 발효를 통해 유산을 최종 산물로 생성한다[1]. 전통적으로 LAB는 식물류, 과일류, 채소류, 곡물류, 육류, 유제품, 토양, 물, 그리고 인간의 몸 등 다양한 곳에서 발견된다[2–4]. LAB는 항균, 항산화, 콜레스테롤 수치 저하, 항비만, 급성 설사치료, 장염치료, 항알레르기, 심혈관 질환예방, 요로 감염 치료 및 면역 활성을 가지고 있다[5–9]. LAB의 중요한 속(genus)은 Lactobacillus spp., Lactococcus spp., Leuconostoc spp., Pediococcus spp., Streptococcus spp. 등이다. 특히, Lactobacillus 속은 안전성이 입증된 프로바이오틱스로 널리 사용되고 있다[10]. 프로바이오틱스는 인간과 동물에게 적절한 양으로 섭취되었을 때 숙주에게 건강상의 이점을 제공하는 살아 있는 미생물이다[11,12]. 특히, 장내 미생물 균형을 개선하여 숙주 동물에게 유익한 영향을 미치는 프로바이오틱 균주를 식품이나 사료로 활용하기 위해서는 산성 및 담즙염에 대한 저항성을 보유하여 일정한 균 수로 생존할 수 있어야 한다. 따라서 프로바이오틱스의 유익한 효과는 주로 위장관의 산 및 담즙 압력을 포함한 스트레스를 견디는 능력[13,14]과 저장 중 생존율[15]에 따라 좌우된다.
배추(Korean cabbage, Brassica rapa subsp. pekinensis)는 십자화과(Cruciferae)에 속하는 두해살이 식물로서 우리나라의 대표적인 채소이다[16]. 배추의 성분은 97% 이상이 수분으로 구성되어 있고, 비타민 A, B1, B2, C, 나이아신(Niacin)과 무기질 K, Ca, P, Fe을 다량 함유하며, 특히 푸른 잎 부분에 비타민 C가 많이 함유되어 있고 항암 활성 성분으로 isothiocyanate가 존재한다[16]. 원재료를 살균하지 않은 김치 발효 과정에서는 다양한 미생물과 LAB의 자연적인 성장이 이루어진다. 발효 김치는 Lactobacillus kimchii, Leuconostoc kimchii, Leuconostoc inhae, Weissella cibaria, Weissella koreensis 등 다양한 유산균을 포함하고 있다[17,18]. 본 연구는 기존 연구자들의 발효 김치에서 유산균을 분리하고 동정한 것이 아닌 순수 배추에 존재하는 유산균을 분리하고, 동정하여 그 유산균의 특성을 연구하였다.
재료 및 방법
배추(Korean cabbage, B. rapa subsp. pekinensis)는 안성시 소재 농협하나로마트에서 신선한 것을 구입하였다. 배추로부터 유산균의 분리는 37℃ 배양기에서 21일간 혐기 발효시켜 유산균을 분리하였다. 유산균의 분리는 0.01% Sodium azide(Sigma-Aldrich, USA)을 첨가한 De Man Rogosa-Sharpe(Difco, USA) agar를 이용하였다. 콜로니 형성 후, 각각의 배양된 MRS agar에서 모양, 크기 및 색이 다른 콜로니를 선택하였다. 선택된 미생물은 API 50CHL kit(BioMerieux, Marcy-I’Etoile, France)을 이용하여 당 이용성을 조사하였다. 즉 단일 콜로니를 접종한 CHL 배지를 각 capsules에 100 μL씩 분주 후 37℃에서 48시간 배양하여 색의 변화를 관찰하였다. 각각의 당 발효패턴을 API web software(https://apiweb.biomerieux.com/)에 입력하여 동정 결과를 확인하였다. 최종적으로 분리된 균주의 동정을 위하여 수탁업체(Solgent, Korea)에 16S rDNA 분석을 의뢰하였다. 그리고 균주의 결정은 데이터베이스에 등록된 표준 균주와 비교하여 가장 높은 상동성을 나타내는 것으로부터 결정하였다. 분리된 유산균은 –80℃에서 보관하면서 실험에 이용하였다.
병원성균인 Escherichia coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli KCCM 11600는 한국미생물보존센터에서 구입하였다. 유산균의 배양 배지는 MRS broth를 이용하여 37℃의 배양기에서 배양하였고, E. coli는 Luria-Bertani(LB) broth(Difco)를 이용하여 37℃의 배양기에서 배양하였다.
배추로부터 분리된 유산균을 MRS broth에 접종하여 37℃의 배양기에서 24시간 배양하였다. 유산균 배양액의 회수는 원심분리기를 이용하여 분리하였다. 즉 원심분리는 4℃, 4,000 rpm, 20 min의 조건으로 수행하였다. 얻어진 상징액의 pH를 측정한 후, Syringe filter(0.45 μm와 0.22 μm, Advantec, Japan)를 이용하여 멸균하였고, –20℃에 보관하면서 실험에 이용하였다.
용혈 활성은 배추로부터 분리·동정된 유산균을 MRS broth에 예비배양한 후, 5%(w/v) defibrinated whole sheep blood(Kisan Biotech, Korea)를 함유 한 blood agar base(Kisan Biotech)에 옮기고 37℃에서 48시간 배양하였다. 용혈 활성은 콜로니 주위의 가수 분해 맑은 영역(β-용혈), 콜로니 주변의 부분 가수 분해 및 녹색 색조 영역(α-용혈), 또는 콜로니 주위의 영역 없음(γ-용혈)을 관찰하였다. γ-용혈은 음성으로 간주하였다.
산 내성은 배추로부터 분리·동정된 유산균을 12시간 배양한 후, 1 N HCl을 사용하여 pH를 2.0으로 조정하였다. 이후 37℃에서 2시간 동안 배양한 뒤, 생존한 균체는 평판 계수법을 통해 MRS 한천배지를 사용하여 계수하였다.
배추로부터 분리·동정된 유산균을 37℃에서 24시간 배양 후, 얻어진 상징액의 병원성균에 대한 항균활성은 paper disc법을 이용하여 확인하였다. 실험에 이용된 병원성균으로는 준비된 E. coli 를 이용하였다. 20 mL의 LB agar를 autoclave에 멸균한 후, 50℃ water bath에 정치하였다. Water bath에 준비된 20 mL의 LB agar에 병원성균을 1%씩 접종하였다. 그리고 petri dish에 부어 굳혔다. 굳어진 각각의 병원성균에 배추 유래 유산균으로부터 얻어진 상징액을 40, 20, 10, 그리고 5 μL의 농도로 조정하여 멸균된 paper disc(Advantec)에 흡수시켜 37℃에 배양하면서 항균활성 환을 측정하였다.
배추로부터 분리·동정된 유산균을 37℃에서 24시간 배양 후, 얻어진 상징액의 병원성균에 대한 농도별 항균활성은 96 well plate법을 이용하여 측정하였다. 준비된 상징액은 20%, 10%, 5%, 2.5%의 농도로 첨가하였다. 각각의 병원성균은 예비 배양 후, 1%를 접종하였다. 병원성균의 성장은 37℃ 배양기에서 배양하면서 3시간 간격으로 microplate reader(Bio-Rad, USA)를 이용하여 655 nm의 파장으로 흡광도(optical density)를 측정하였다.
배추로부터 분리·동정된 유산균을 37℃에서 24시간 배양 후, 얻어진 배양 상징액에 대하여 pH와 열에 대한 안정성을 측정하였다. pH 변화에 대한 항균활성 유지 여부는 1N NaOH를 이용하여 배양 상징액에 pH 7.0으로 조정하고, 배지에 5% 첨가에 의해 병원성 균주에 대한 항균활성을 측정하였다. 그리고 배양 상징액에 함유된 항균물질의 열안정성 시험은 배양 상징액을 65℃에서 30 min, 75℃에서 15 min, 85℃에서 10 min, 100℃에서 5 min의 조건으로 열처리한 후, 배지에 5% 첨가에 의해 병원성 균주에 대한 항균활성을 측정하였다. 각각의 병원성균의 성장은 37℃에서 24시간 동안 배양하면서 6시간 간격으로 흡광도를 측정하여 확인하였다.
결과 및 고찰
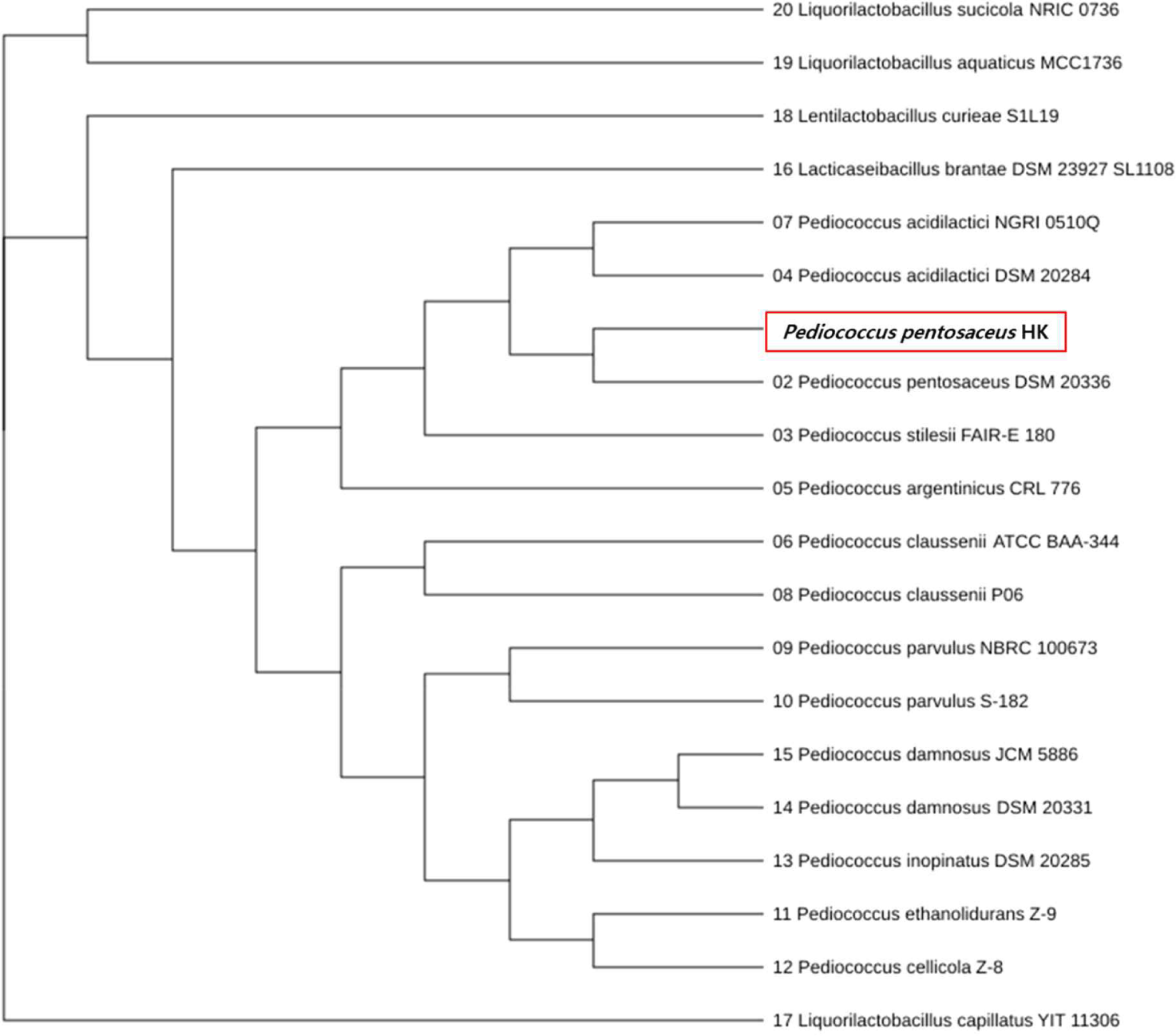
21일간 혐기 발효한 배추를 분쇄한 후, 백금이를 이용하여 sodium azid가 함유된 MRS agar에 streaking하여 37℃ 인큐베이터에서 콜로니가 형성될 때까지 혐기상태로 배양하였다. 배양 후 얻어진 콜로니를 그람염색법으로 균의 형태, 양성과 음성 여부를 확인하였다(Fig. 1A). Fig. 1B와 같이 배추 발효로부터 얻어진 콜로니는 그람 양성의 구균으로 확인되었다. API 50CHL kit를 이용하여 선택된 유산균의 당 이용성을 분석한 결과, Pediococcus pentosaceus와 99.9%의 상동성을 보여주었다(Table 1). 더욱이 16S rDNA 염기서열을 분석하고 상동성을 검색한 결과는 Fig. 2와 같이 P. pentosaceus 와 99%의 상동성이 확인되었다. 최종 분리한 균주를 P. pentosaceus HK로 표기하였다. P. pentosaceus HK를 10 mL MRS broth에 24시간 1차 배양하고, 1차 배양액으로부터 50 mL MRS broth에 1% 접종하여 24시간 2차 배양하였다. 배양 종료 후, 배양 상징액은 원심분리기를 이용하여 회수하였다. 그리고 0.22 μm의 syringe filter를 이용하여 유산균을 제거하였다. 이때 배양 상징액의 pH는 3.73을 나타내었다.

배추로부터 분리·동정된 P. pentosaceus HK의 용혈활성을 시험한 결과는 Fig. 3에 나타내었다. Fig. 3에 보여주는 바와 같이 P. pentosaceus HK는 콜로니 주위에 가수분해 및 녹색 색조를 나타내지 않았다(Fig. 3A). 시험에 대조군으로 안정성이 확인된 Lactobacillus bulgaricus(Fig. 3B)와 Streptococcus thermophilus(Fig. 3C)와 같은 결과를 보여주었다.

배추로부터 분리·동정된 P. pentosaceus HK의 산에 의한 생존력을 측정하기 위하여 MRS broth에 접종하고 37℃ 인큐베이터에서 12시간 배양하였다. 이때의 배지내 pH는 4.2를 나타내었고, 생균수는 9.34 Log CFU/mL를 나타내었다(Fig. 4). 그리고 12시간 배양된 배지에 1 N HCl을 사용하여 pH 2.0으로 조정하였다. 이후 37℃에서 2시간 동안 배양한 뒤, P. pentosaceus HK의 생존한 균수는 초기 9.34 Log CFU/mL에서 5.74 Log CFU/mL를 나타내었다(Fig. 4).
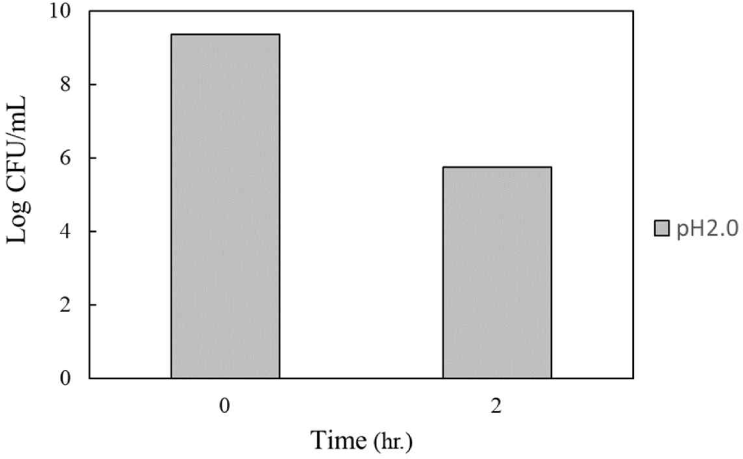
Shin et al.[19]은 P. pentosaceus SH-10의 배양 시간에 따른 pH 변화를 검토한 결과, 12시간 후에 4.13, 배양 24시간 후 pH는 3.9 정도라고 하였다. 이러한 연구결과는 우리의 결과와 유사한 결과를 보여주었다. 또한 Song et al.[20]은 백합 식혜에서 분리한 P. pentosaceus SH-10은 내산성이 뛰어났다는 결과와도 유사한 결과를 보여주었다.
배추로부터 분리·동정된 P. pentosaceus HK로부터 얻어진 상징액의 농도를 조절하여 병원성 E. coli 에 대한 paper disc법을 이용한 항균활성을 측정한 결과는 Fig. 5에 나타내었다. Fig. 5는 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli 11600에 대하여 P. pentosaceus HK로부터 얻어진 상징액에 대한 항균 활성을 나타내었다. 항균 환은 배양 상징액의 농도가 높을수록 사이즈가 큰 것으로 확인되었다(Fig. 5). 항균활성에 있어서 Escherichia coli에 대한 감수성은 E. coli KCCM 11591이 10 μL의 농도에서도 항균 환을 보여주었다(Fig. 5B). 그리고 E. coli KCCM 11596과 E. coli 11600에서는 20 μL 이상의 농도에서 항균환을 보여주었다(Fig. 5C and D). 그러나 E. coli KCCM 11587는 40 μL의 농도에서 항균 환을 보여주었다(Fig. 5A). 따라서 배추로부터 분리·동정된 P. pentosaceus HK로부터 얻어진 상징액은 병원성균의 성장을 억제하는 효과가 있는 것으로 확인되었다.

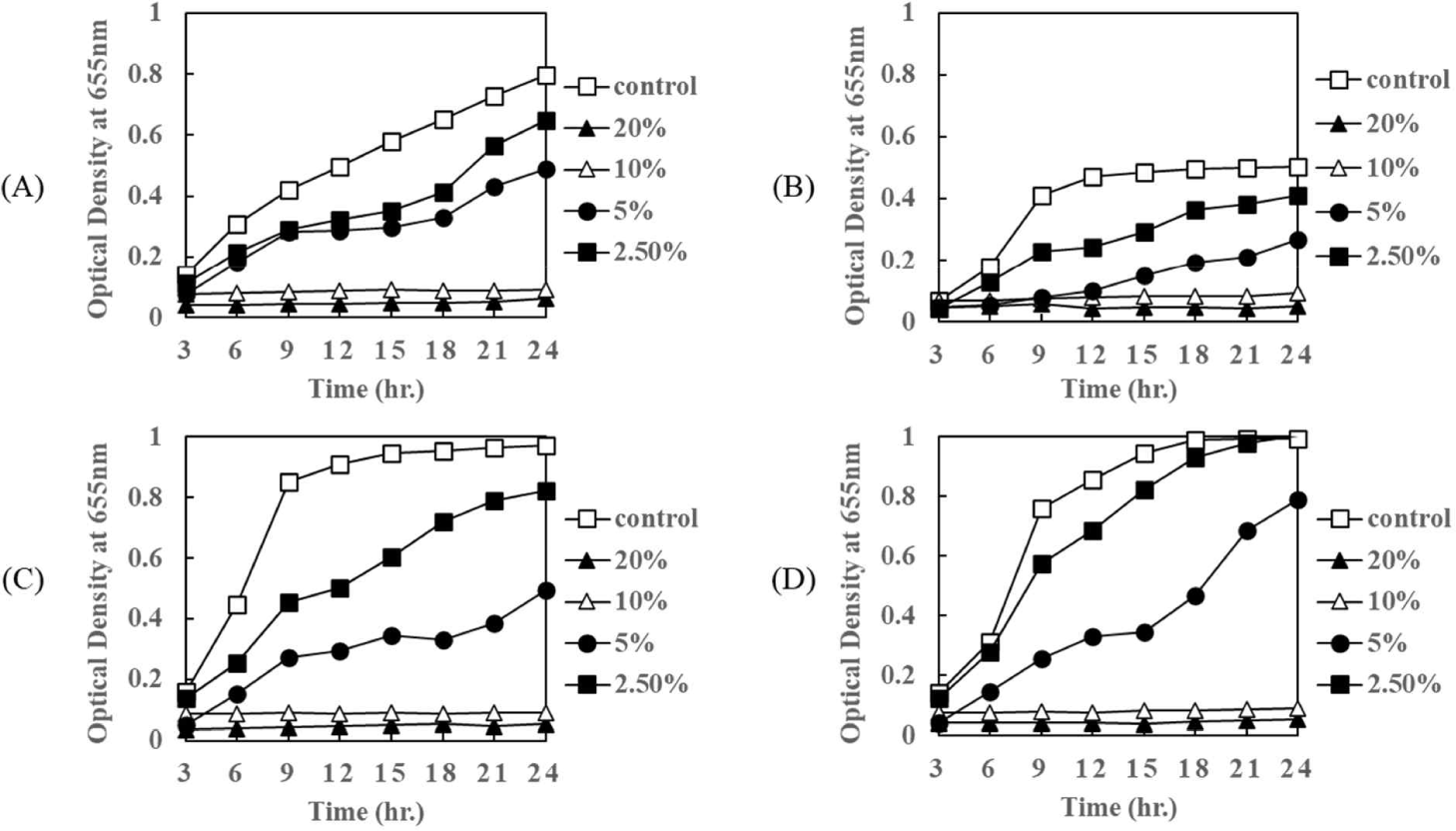
배추로부터 분리·동정된 P. pentosaceus HK로부터 얻어진 상징액이 병원성 E. coli 에 대한 항균활성 여부는 paper disc법에 의해 확인되었다(Fig. 5). 상징액의 항균활성의 최소 농도(Minimum Inhibition Concentration, MIC)를 측정하기 위하여 96 well plate법으로 진행하였다. Fig. 6은 P. pentosaceus HK로부터 얻어진 상징액을 20%, 10%, 5%, 2.5% 농도로 첨가한 후, 24시간 동안 병원성 E. coli에 대한 항균활성을 측정한 결과이다. 시험에 이용된 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli 11600은 20%와 10%의 농도에서 배양초기부터 강한 항균활성을 나타내어 배양 종료 시까지 전혀 발육이 성장하지 못하였다(Fig. 6). 그리고 각 E. coli 에 대한 P. pentosaceus HK로부터 얻어진 상징액의 항균활성은 배양 상징액의 농도가 높을수록 강한 항균활성을 나타내었고, 배양 상징액을 첨가하지 않은 대조구에 비해 낮은 농도(2.5%와 5%)에서 항균활성을 보여주었다(Fig. 6).
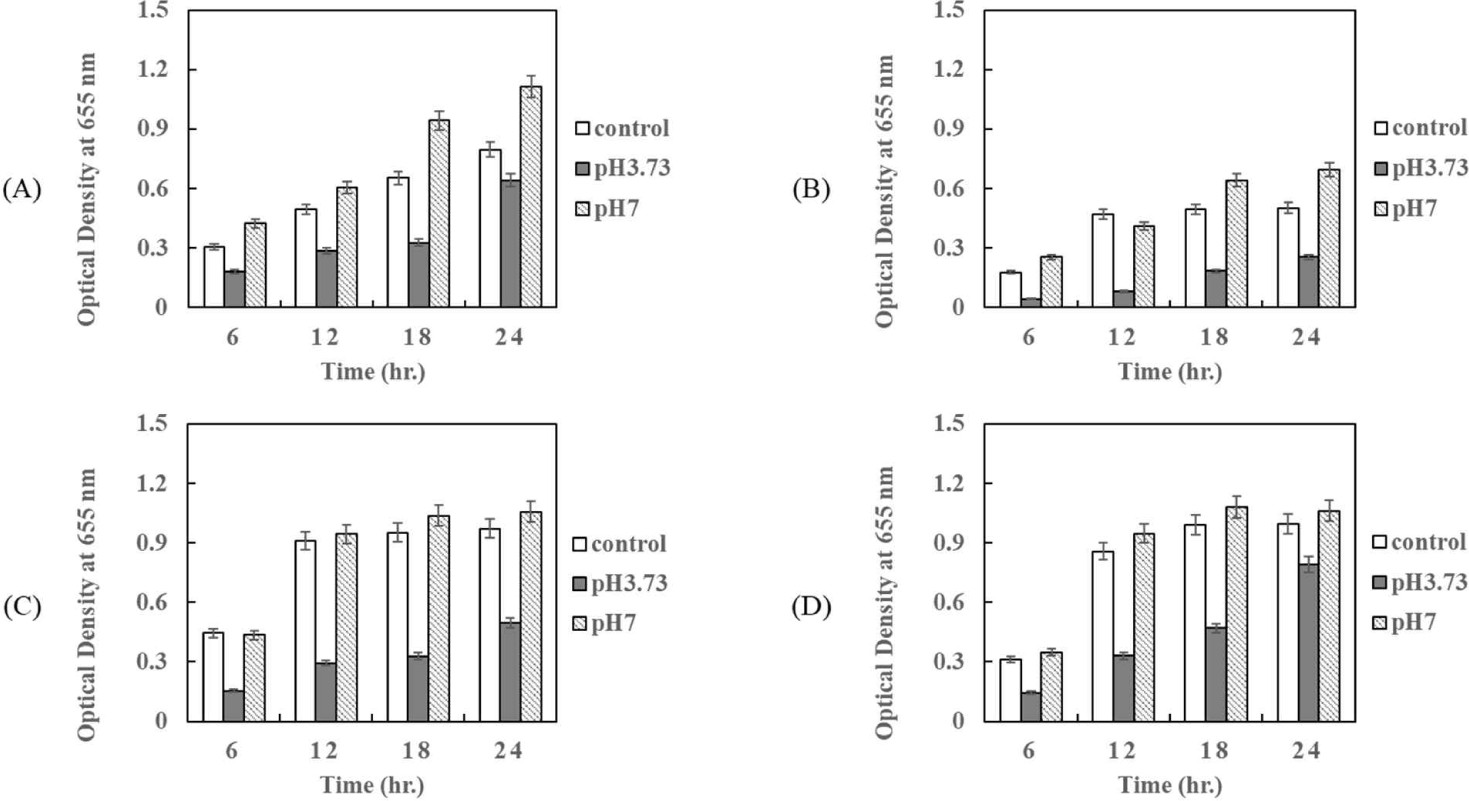
P. pentosaceus HK로부터 얻어진 상징액의 항균활성이 pH 변화에 의해서도 활성이 유지되는지를 알아보기 위해 배양상징액을 1N NaOH를 사용하여 pH 7.0으로 조정하고, 배지에 5%를 첨가하여 병원성 E. coli 에 대한 항균활성을 확인하였다. MRS 배지에서 P. pentosaceus HK 접종 배양하여 37℃ 인큐베이터에서 24시간 배양 후 상징액의 pH는 3.73로 측정되었다. Fig. 7은 배양 상징액을 pH 7.0으로 조정하여 첨가 후, 96 well plate법을 이용하여 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, 그리고 E. coli KCCM 11600의 24시간 동안 성장을 측정한 결과이다. 모든 시험구에서 배양 상징액의 pH를 7.0으로 조정하였을 때, 항균활성은 나타나지 않았으며, 오히려 아무것도 첨가하지 않은 대조구보다 높은 성장을 보여주었다(Fig. 7).
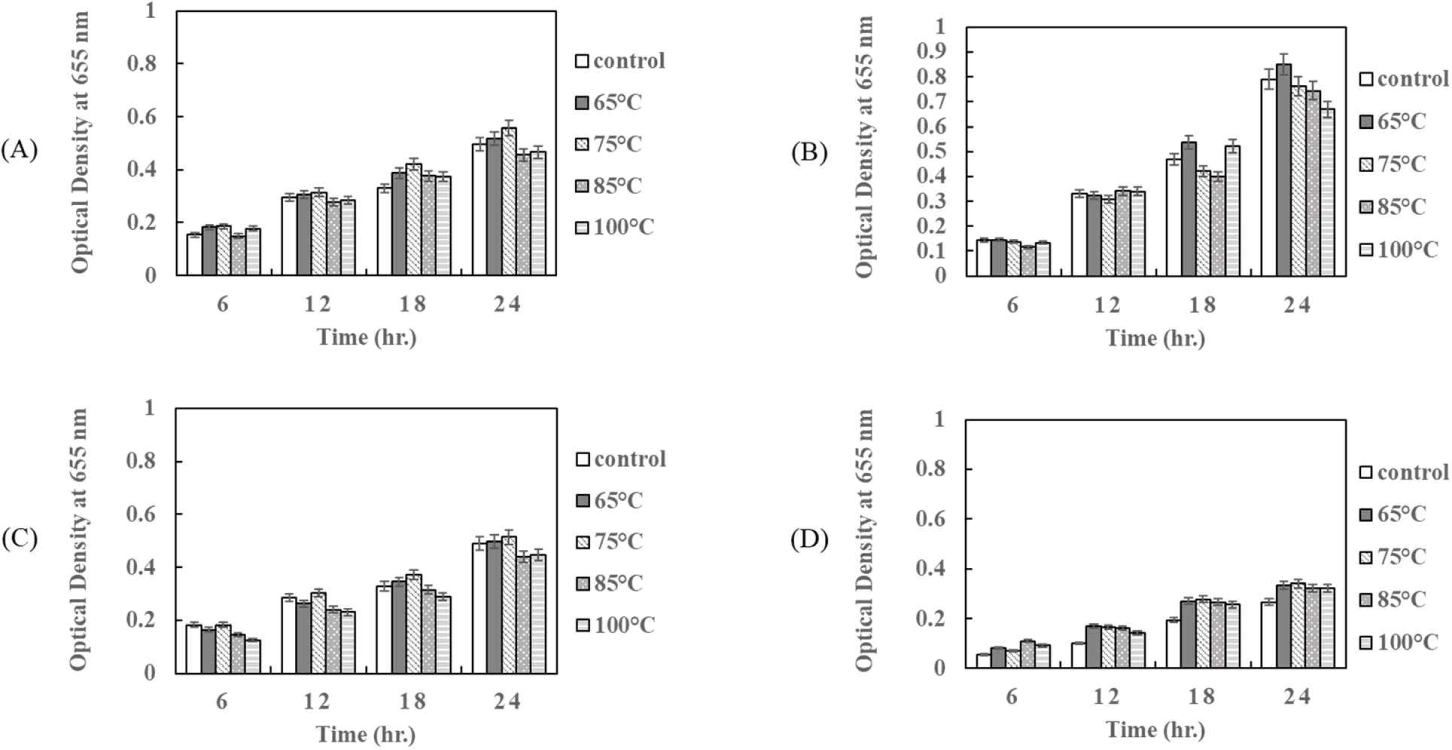
한편, P. pentosaceus HK로부터 얻어진 상징액의 항균활성이 열에 대하여 안정성을 가지는지를 측정하였다. 즉 65℃에서 30 min, 75℃에서 15 min, 85℃에서 10 min, 100℃에서 5 min의 조건으로 열처리하여 병원성 E. coli 에 대한 항균활성을 확인한 결과는 Fig. 8에 보여주었다. Fig. 8은 배양 상징액을 각각의 온도에서 열처리한 후, 준비된 각각의 E. coli 에 대한 항균활성을 나타내었다. 모든 온도 처리구에서 온도 처리하지 않은 대조구와 같은 항균활성을 보여주었다(Fig. 8). 균주마다 온도처리에 따른 성장 억제는 조금씩 차이를 보여주었다. E. coli KCCM 11591를 제외한 나머지 E. coli KCCM 11587, E. coli KCCM 11596, 그리고 E. coli KCCM 11600에서는 85℃에서 10 min과 100℃에서 5 min 열처리한 처리구에서 열처리를 하지 않은 대조구에 비해 현저한 항균활성을 나타내었다(Fig. 8A, C and D).
Pediococcus 속은 페디오신(pediocin)이라는 Class IIa 그룹에 속하는 박테리오신을 생산한다. Pediococcus 속에는 P. acidilactici, P. pentosaceus, P. damnosus, P. cellicola, P. parvulus, P. stilesii, P. inopinatus, P. claussenii, P. ethanolidurans와 같은 여러 종이 있다[21]. Ayivi et al.[9]은 인간 장내에서 분리된 P. acidilactici 균주가 생성하는 박테리오신을 처음으로 보고하였다. 그리고 Halami et al.[22]은 채소에서 분리된 P. pentosaceus ACCEL에서 박테리오신을 정제하고 특성을 연구하였다. P. acidilactici M은 Staphylococcus aureus, Listeria monocytogenes, Clostridium perfringens, Bacillus coagulans, Bacillus cereus, Aeromonas hydrophila의 생육을 억제시켰다고 하였다[23]. 또한 Cotter et al.[24]에 의한 박테리오신 분류에 따르면, 페디오신(pediocins)은 일부 유산균(LAB)에 의해 합성될 수 있는 생체 분자로, 그람 양성균에 대해 광범위한 항균 활성을 나타낸다고 하였다. 이는 특히 L. monocytogenes와 같은 병원성 세균에 대하여 강한 항균활성을 나타낸다고 하였다. 그리고 Shin et al.[19]은 백합 식해에서 분리한 P. pentosaceus SH-10 균주는 B. cereus KCCM40138, L. monocytogenes KCCM40307, Salmonella choleraesuis KCCM11806, S. aureus KCCM12214에 대하여 배양 시간에 따라 점점 감소하다가 배양 18시간에 병원성균들이 검출되지 않았다고 하였다. 그들은 그 이유에 대하여 P. pentosaceus SH-10이 생산하는 살균활성을 나타내는 물질, 특히 sodium lactate 등의 유기산 생산에 의한 배지 중 pH의 산성화에 의해 병원성 세균이 사멸한 것이라고 하였다. 왜냐하면 이들은 P. pentosaceus SH-10이 pediocin 생산여부를 시험한 결과, 생산하지 못하는 것을 확인하였기 때문이다. Diep et al.[25]은 P. pentosaceus는 균주에 따라 pediocin의 생산량이 매우 적거나 없는 경우가 있는데 그 원인은 관련 유전자의 소실에 의한다고 하였다. 또한 Niamah[26]에 의하면 페디오신의 활성은 식품 내에서 pH, 열 처리, 프로테아제(단백질 분해 효소), 염, 저장 기간과 같은 여러 요인의 영향을 받는다고 보고하였다. 페디오신(Pediocin)은 100℃의 끓는 온도나 121℃의 멸균 온도와 같은 고온에서도 안정한 펩타이드로 알려져 있다[27,28]. 페디오신이 다른 박테리오신(bacteriocin)과 구별되는 중요한 특징인 내열성은 구조 내의 이황화 결합(disulfide bonds)과 관련이 있는 것으로 보고하였다[28–30]. P. pentosaceus의 박테리오신 PB2는 30℃, 40℃, 50℃, 60℃, 80℃에서 2시간 동안 열 안정성을 유지하는 것으로 확인되었다. 그러나 Wang et al.[28]는 고온에서도 항균 활성을 유지하지만, 121℃에서 페디오신 활성이 50% 감소한 것으로 보아 구조적으로 부분적인 분해가 발생할 수 있어 활성이 일부 감소하는 현상이 관찰되었다고 하였다. 그리고 Barathiraja et al.[31]은 염소의 반추액에서 정제된 박테리오신이 30℃에서는 안정하였지만, 100℃에서 30분 동안 불안정해지는 특성을 보였다고 하였다.
한편 박테리오신의 pH 안정성에 대한 연구를 살펴보면, Pascual et al.[32]은 Lactobacillus fermentum L23에서 생산된 박테리오신 L23은 pH 4.0–7.0 범위에서 안정성을 보였으나, pH 2.0, 3.0, 8.0, 9.0에서 처리되었을 때 활성을 잃었다고 하였다. 반면 Pedicin Gs4는 병원성균에 대해 pH 5.0–7.0 범위에서도 높은 안정성을 나타내었다고 하였다. 또한 Lactococcus subspecies에서 생성된 니신 유사 박테리오신은 pH 2.0–4.0 범위에서 처리 후 안정성을 보였다고 하였다 [33]. 본 연구에서 pH 7.0으로 조정하여 항균활성을 측정한 결과, 항균활성이 나타나지 않았는데 이러한 원인에 대해서는 상기 연구자들의 연구를 토대로 상징액을 다양한 pH 범위로 조정하여 항균활성을 검토할 필요성이 제기되었다. Ghosh et al.[34]는 P. pentosaceus GS4의 신선한 CFS에서 높은 항균 활성이 나타나는 것은 유산과 기타 항균제(에탄올 및 과산화수소), 그리고 단백질 유사 항균제(박테리오신)의 시너지 효과로 설명하였다. 그러나 P. pentosaceus GS4 균주는 호모형구균이기 때문에 유산과 박테리오신 유사 단백질을 생성할 수 있지만, 에탄올과 과산화수소는 생성하지 않는다. Ghosh et al.[34]는 P. pentosaceus GS4의 배양상징액에서 항균 활성이 관찰되었으며, 이는 박테리오신 유사 항균제가 존재한다고 하였다. 또한 이들은 P. pentosaceus GS4의 중화된 배양 상징액과 처리하지 않은 대조군을 S. aureus, P. aeruginosa, E. coli, L. monocytogenes에 대해 항균 활성을 비교한 결과, 억제 효과는 박테리오신 유사 단백질 분자와 같은 억제 물질에 기인한 것으로 보고하였다. 또한 Coconnier et al.[35]은 Lactobacillus acidophilus LB 균주의 사용 후 배양 상층액이 S. aureus, L. monocytogenes, E. coli 뿐만 아니라 S. typhimurium, Shigella flexneri, Klebsiella pneumoniae, Enterobacter spp.의 생존율을 감소시켰다고 하였다. Chon et al.[36]은 유산균의 병원성균에 대한 항균활성은 유산을 포함한 유기산, 짧은 고리 지방산, hydrogen peroxide, bacteriocin 등이 관여한다고 하였다. 따라서 본 연구에서 P. pentosaceus HK로부터 얻어진 상징액의 E. coli 에 대한 항균활성은 Chon et al.[36]에 의한 의견에 동의하며 병원성균에 대한 항균활성이 유기산, 박테리오신 또는 hydrogen peroxide에 의한 것인지 보다 더 추가적인 연구를 수행할 필요성이 있다.
결 론
본 연구는 배추로부터 유산균을 분리하였고, 분리된 유산균을 동정결과 P. pentosaceus strain으로 밝혀졌다. 본 연구에서 동정된 유산균은 P. pentosaceus HK로 표기하였다. P. pentosaceus HK는 용혈활성을 시험한 결과, 콜로니 주위에 가수분해 및 녹색 색조를 나타나지 않아 안전성이 확인되었다. 그리고 P. pentosaceus HK의 산에 의한 생존력을 측정하기 위하여 pH 2.0으로 조정한 후, 37℃에서 2시간 동안 배양한 뒤, 생존한 균수는 초기 9.34 Log CFU/mL에서 5.74 Log CFU/mL를 나타내어 내산성이 강한 것이 확인되었다. 또한 P. pentosaceus HK로부터 얻어진 상징액의 병원성 E. coli 에 대한 항균활성을 나타내는지 조사하였다. P. pentosaceus HK로부터 얻어진 배양 상징액은 병원성 E. coli KCCM 11587, E. coli KCCM 11591, E. coli KCCM 11596, E. coli KCCM 11600에 대하여 현저한 항균활성을 보여주었다. 항균활성은 배양 상징액 첨가량이 증가할수록 현저한 효과를 보여주었다. 이러한 항균활성은 pH 3.73에서 보여주었고, pH 7.0 조정에서는 항균활성이 나타나지 않았다. 그리고 다양한 열변성에 의한 항균활성은 모든 시험구에서 안정한 효과를 나타내었다.






