서 론
치즈 제조 시 사용되는 유산균스타터는 발효를 위해 사용하는 순수 미생물 배양물이다. 치즈에서 스타터의 주요한 역할은 유당으로부터 유산을 생성하여 치즈의 pH를 결정한다. 유산 생성이 중요한 것은 산 생성 진행의 흐름이 숙성과정의 진행을 판단할 수 있는 기준이 되고 치즈성분 구성의 변화와 최종 치즈제품의 품질 특성을 제공하는 데 매우 깊게 영향을 미친다. 또한 치즈 숙성에 소요되는 효소류를 지속적으로 공급해주어 치즈의 고유한 맛을 생성하도록 숙성을 이끌어 어떤 스타터를 사용하느냐에 따라 치즈의 독특한 맛이 결정된다고 볼 수 있다[1]. 우리나라 최초의 치즈는 임실에서부터 시작되었다. 1964년 임실 성당의 주임신부로 부임한 벨기에 출신의 지정환 신부님(본명 디디에 세스테반스) 동료 선교사로부터 선물을 받은 산양 2마리를 이용하여 임실산양협동조합을 설립하였다. 그러나 산양유의 공급이 늘어나면서 가공을 하지 못하는 산양유가 발생하자 1967년 치즈로 생산하기 시작하여 1968년 한국 최초의 까망베르치즈 제조에 성공하여 브랜드 정환치즈로 납품하기 시작하였다. 하지만 판매는 미미하였으며 저장기간이 짧고 보관이 어려워 1970년 3개월 이상 보관이 가능한 체다치즈를 상품화하기 시작하였다[2]. 이렇게 시작된 약 60년 전 우리나라 최초의 임실치즈동굴 숙성실에서 생산된 까망베르치즈와 체다치즈 등 다양한 치즈를 숙성하였다. 체다치즈는 일반적으로 신맛이 강하고 부드러우면서 단단한 형태를 띄고 있고 지방이 32%이며 주로 노란색을 하고 있는데, 천연색소(Annato, 치자 등)를 통해 레드체다로 나타내기도 하고 화이트체다로 구별하여 제조하기도 한다. 또한 다른 치즈들과 다르게 제조 중에 체다링(cheddaring) 공정을 진행한다[3]. 본 연구에서는 임실치즈 명성의 시작점, 임실 성가리에 위치한 우리나라 최초의 치즈동굴 숙성실에서 약 60년 전에 생산된 숙성치즈를 복원하고자 당시 사용하였던 숙성실에서 피펫스왑 표면검사키트를 통한 미생물 유전체를 분석하여 군집구조를 분석하였고, 채취해온 유산균은 37℃, 30℃로 배양하여 성장이 우수한 균주를 선별하여 활성평가를 토대로 유산균을 선별하여 16s rRNA로 염기서열을 분석을 진행하였다. 염기서열을 통한 유산균 중 프로바이오틱스 평가와 유제품 유산균으로 알려진 균 8종에서 유산균 유제품으로 알려진 6개의 유산균을 유제품 스타터로 적합한지 평가한 후 최종 10% 환원 탈지유에 접종한 6개의 유산균 모두 12시간에 pH는 4.6–4.7 사이로 떨어졌으며, 적정산도는 0.8%–0.9%, 유산균 수는 108–1010인 것을 확인할 수 있었다. 이 중 중온균 스타터로 많이 사용되고 3종을 선택하여 체다치즈에 이용하여 보조균주로써의 품질 특성을 알아보고자 하였다.
재료 및 방법
체다치즈 제조는 임실치즈앤식품연구소에서 제조하였고, 사용된 원유는 임실 소재 감성유가공목장에서 구입하여 사용하였다. 사용된 유산균스타터는 원유 100 kg 기준으로 상업적 균주 함유량 10 U(3 g)으로 첨가하기에 R703(Lactococcus lactis subsp. Lactis, L. lactis subsp. cremoris, Streptococcus thermophiles, Chr-Hansen, Denmark)를 3 g을 첨가하여 대조구를 제조하였고, 시험구는 동결된 선별균주 3종(L. lactis subsp. lactis(LL), L. lactis subsp. cremoris(LC), and S. thermophiles(ST)을 각각 1 g씩과 R703를 3 g을 추가적으로 더 첨가하여 사용되었다. 이는 동결된 선별균주의 경우 선행실험 결과, 상업적 균주에 비해 균의 활력도가 상업적균주(유산균 수 1014 이상)가 선별균주(유산균 수 108–1010)로 낮아 치즈 숙성이 잘 이루어지지 않아 보조균주로 사용하고자 하였으며 제조 완료된 체다치즈는 1-2일 건조 후 진공포장을 통해 4개월간 숙성을 진행하였다.
pH는 멸균생리식염수와 치즈를 2:1의 비율로 균질하여 pH meter(Orion star 211A, Thermo Fisher Scientific, USA)를 이용하여 2개월마다 측정하였다. 유산균수는 pH와 동일한 방법으로 균질된 샘플을 1 mL 취하여 희석한 후 유산균 건조필름에 희석액 1 mL를 분주하여 35℃에서 24–48시간 배양하여 파란색을 나타내는 colony를 계수하였다.
숙성기간별 체다치즈에 대한 일반성분은 Petri dish에 치즈 30 g을 잘게 빈틈없이 꼭 누른 후 FoodScanTM2(FoodScanTM2Dariy, FOSS, Denmark)로 Fat, Protein, Moisture, Salt, Total solid에 대한 분석을 실시하였다. 적정산도는 균질화된 시료 9 g에 동량의 증류수를 가한 후 1% 페놀프탈레인 0.5 mL를 첨가하고 0.1N NaOH로 적정하여 분홍색이 30초 유지될 때의 소비량을 측정하였다.
숙성에 따른 단백질 분해도를 보기 위한 시료의 전처리는 멸균생리식염수와 치즈를 2:1의 비율로 혼합하고 균질한 뒤 5℃, 3,000×g에서 30분간 원심분리(Combi R515, Hanil Science Industrial, Korea)하여 상층부의 지방을 제거하고 남은 액을 여과하여 사용하였다. NPN(nonprotein nitrogen) 측정은 여과액 2.5 mL에 reagent A(12% trichloroacetic acid) 5 mL와 증류수 0.5 mL를 혼합하여 실온에서 20분간 방치하고 여과하여 2.5 mL를 취하였다. 이후 여과액 2.5 mL에 reagent B(증류수 500 mL, Sodium carbonate 75 g, sodium hexametaphosphate 10 g) 5 mL와 reagent C(Phenol reagent 50 mL, 증류수 100 mL) 1.5 mL를 차례대로 혼합하여 30℃ 항온수조(HQ-DW22, CORETECH, Korea)에서 30분간 발색하였다. NCN(noncasein nitrogen)은 위의 여과액 2.5 mL에 1M acetate buffer(pH 4.6) 2.5 mL를 가하여 37℃ 항온수조에서 20분간 방치한 뒤, 여과하여 NPN과 같은 방법으로 발색시켰다.
발색이 끝난 후 NPN 640 nm NCN은 570 nm에서 spectrophoto meter(Libra S22, Biochrom, UK)를 사용하여 흡광도를 측정하였으며, 이들의 함량은 tyrosine을 표준물질로 하여 작성한 표준곡선과 환산을 위한 직선 회귀식에 의거 계산하였다.
유리아미노산 분석은 4개월 숙성된 치즈를 아미노산 자동분석기(LA8080, Hitachi, Japan)로 분석하였다. 분석조건으로 컬럼은 custom ion-exchange resin(4.6 mm×60 mm, Hitachi)를 사용하였고, 온도는 57℃로 조절하였다. 이동상으로는 Buffer for high speed amino acid analyzer ph set 및 Ninhydrin coloring solution kit가 사용되었고, 주입량은 20 μL, 측정파장은 570 nm, 440 nm였으며 Post ninhydrin reaction을 위한 온도는 135℃였다.
4개월 숙성된 체다치즈의 향 차이 비교를 위해 전자코(HERACLES-II, Alpah MOS, France)를 이용하였으며, MTX-5(10 m×0.18 mm×0.40 μm), MXT-1701(10 m×0.18 mm×0.40 μm) column 및 flame ionization detector로 분석을 실시하였다. 휘발성 향기 성분을 headspace extraction하여 포집하였다. Kovats index library를 기반으로 하는 AroChemBase(Alpha MOS, Alpah MOS)의 88,000여 개의 화합물 정보를 통해 샘플에서 검출된 각 피크가 나타내는 성분을 추정하였으며, 3회 분석결과를 주성분 분석(principal component analysis, PCA)에 사용하였다. 통계분석은 Alpha MOS에서 제공된 소프트웨어 Alpha soft(Version 14.2, Alpah MOS)로 수행되었다.
체다치즈의 맛은 전자혀(Astree, Alpah MOS)를 Autosampler를 이용하여 분석하였다. 각 시료 25 mL를 120초 동안 분석한 후 AHS는 신맛, CTS는 짠맛, ANS는 쓴맛, PKS는 단맛, NMS는 감칠맛을 감지하고, CPS와 SCS는 standard로서 사용되었다. 7개의 맛 센서는 센서 감응도에 따라 전체적인 맛을 센싱하였고, 통계분석은 Alpha MOS에서 제공된 소프트웨어 Alpha soft(Version 14.2, Alpah MOS)로 수행하였다. 각 시료는 5회 반복 측정하였고, 센서값을 맛 가치 값(Taster Value, 12점 척도)으로 변환하였다.
체다치즈의 관능검사는 임실치즈앤식품연구소 연구원 대상 10명을 대상으로 제품에 대한 검사를 실시하였다. 관능 검사방법은 9점 척도법으로 진행하여 [1점 “매우 싫다”, 9점 “매우 좋다”]로 평가하였다. 평가 속성은 “외관, 색감, 조직감, 풍미, 전체적인 선호도”에 대해 검사하였다.
본 실험에서 얻어진 결과의 통계처리는 SAS Program(SAS, USA)을 이용하여 ANOVA 분석하였으며, 각 시험 군 사이의 유의성은 p<0.05 수준에서 Fisher’s least significant difference test를 통하여 검정하였다. 전자혀는 Alpha MOS에서 제공된 소프트웨어 Alpha soft(Version 14.2, Alpah MOS, Toulouse, France)로 수행하였고, 각 시료는 5회 반복 측정하여 센서값을 맛 가치 값(Taster Value, 12점 척도)으로 변환하였다.
결과 및 고찰
pH 및 유산균수 측정에 대한 결과는 Table 1과 같다. 숙성 기간 동안 체다치즈에 대한 대조구와 첨가구의 pH의 변화는 5.2–5.3로 유의적 차이가 없는 것으로 나타났고, 치즈숙성 기간이 경과함에 따라 pH가 다소 상승한다는 보고(McSweeney & Fox, 1997)와 일치하였다[4]. 유산균수는 대조구에서는 9.1×107 cfu/g에서 숙성 4개월 후 7.8×108 cfu/g로 첨가구는 1.7×108 cfu/g에서 4.4×108 cfu/g로 나타났으며, 두 샘플 간의 유의적 차이가 없는 것으로 나타났다. 이는 Lee & Nam(1996)은 숙성 초기 커드 내에 잔존하는 lactose 분해에 의한 lactic acid의 생성으로 인해 pH가 약간 감소한 후 pH의 상승이 일어나는데 이는 단백질 분해와 암모니아 생성에 따른 상승이라는 보고와 같았다[5].
| Component | Control1) | Treatment | ||||
|---|---|---|---|---|---|---|
| 0 M | 2 M | 4 M | 0 M | 2 M | 4 M | |
| pH | 5.282±0.668a | 5.312±0.807a | 5.340±0.92a | 5.240±0.668a | 5.286±0.807a | 5.326±0.92a |
| LAB | 9.1×107 | 9.4×107 | 7.8×108 | 1.7×108 | 2.2×108 | 4.4×108 |
일반성분 및 적정산도 변화에 대한 결과는 Table 2와 같았다. 수분은 대조구에서는 숙성초기 36.87 g에서 숙성 4개월 후 36.32 g로 감소하는 것을 볼 수 있었고, 첨가구는 숙성초기 36.13 g에서 숙성 4개월 후 35.73 g로 나타나 두 샘플 간의 유의적 차이는 없는 것으로 나타났다. 지방과 단백질은 대조구에서 숙성초기 지방의 경우 34.98 g에서 36.02 g, 단백질의 경우 24.34 g에서 25.50 g으로 변화하였고, 첨가구에서 숙성초기 지방은 34.59 g에서 35.82 g으로 단백질은 24.40 g에서 24.46 g으로 감소하는 것을 알 수 있었지만 유의적 차이는 없는 것으로 나타났다. 염분은 각 치즈별로 차이가 있었고, 총고형분의 경우 대조구의 경우 숙성초기 63.18%에서 63.93%로 증가하였고 첨가구는 63.97%에서 64.80%로 증가하는 경향을 보였으나 큰 유의적 차이는 없었다. 적정산도는 숙성초기 대조구는 0.64%에서 0.60%로 첨가구는 0.64%에서 0.61%로 감소하는 경향을 보였는데 이는 Park et al.(2006)이 산도의 증가는 유산균 발효중 유산균의 대사산물로서 다양한 유기산 및 아미노산이 생성되고 이들이 적정산도에 영향을 주며 유산균 생육지표라고 보고하였다[6].
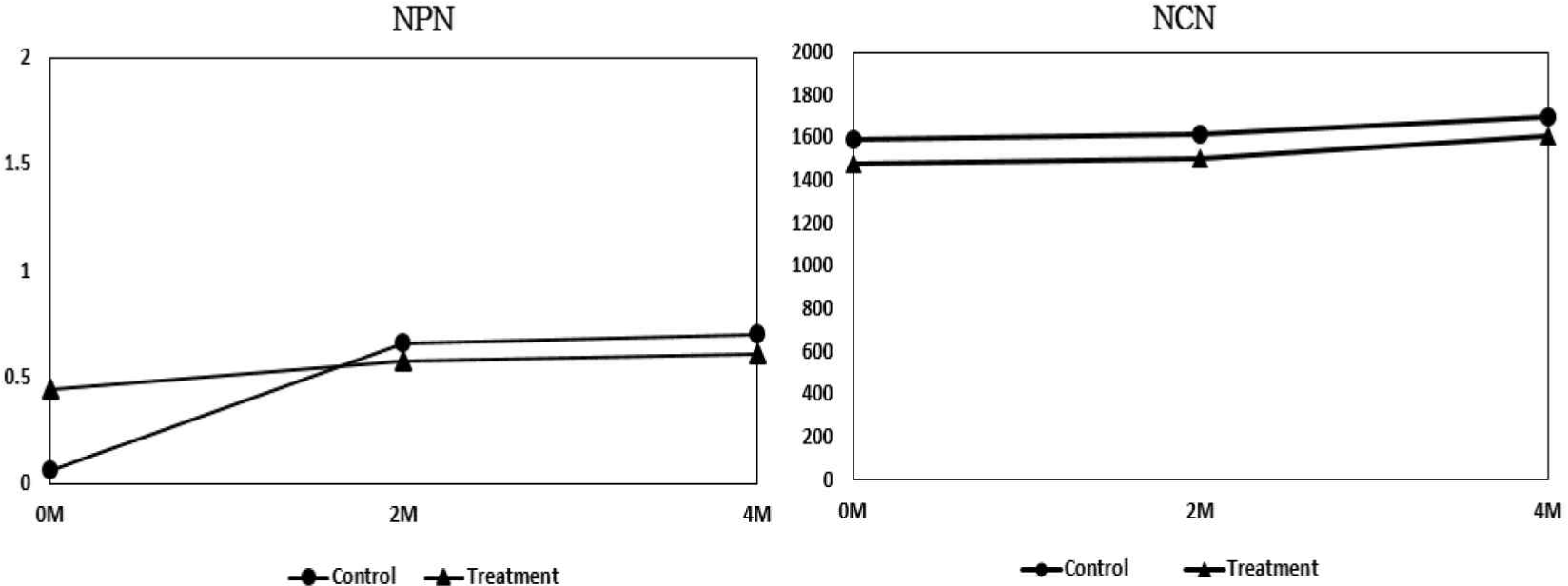
숙성기간별 숙성과정 중 단백질 분해도에 대한 결과는 Fig. 1과 같다. 숙성기간에 따른 단백질 분해도를 위해 NPN, NCN의 변화를 측정하였다. 대조구의 NPN 함량은 0.61 μg/g에서 0.7 μg/g로 첨가구는 0.44 μg/g에서 0.61 μg/g이고, NCN 함량은 대조구 1,588.95 μg/g에서 1,692.05 μg/g로 첨가구의 경우 1,477.20 μg/g에서 1,611.78 μg/g로 숙성기간 동안 증가하는 경향을 보였다. 숙성이 진행되면서 치즈내에서 효소작용을 받은 Casein의 분해산물에 의한 것으로 사료되며, 숙성 중 치즈 대부분의 질소화합물이 유산균 스타터에 의해 생성된 단백질분해효소와 잔류 렌넷의 작용에 의해 생성되기 때문이라는 Galán et al.[7]의 연구와 일치하였다. Rank et al.[8]의 연구에서 질소화합물은 대부분이 렌넷에 의해 생성되어 치즈 숙성이 될수록 증가한다고 보고하여 NPN과 NCN 함량 증가가 치즈 숙성도 판단 지표가 될 수 있음을 제시한 바 있다.
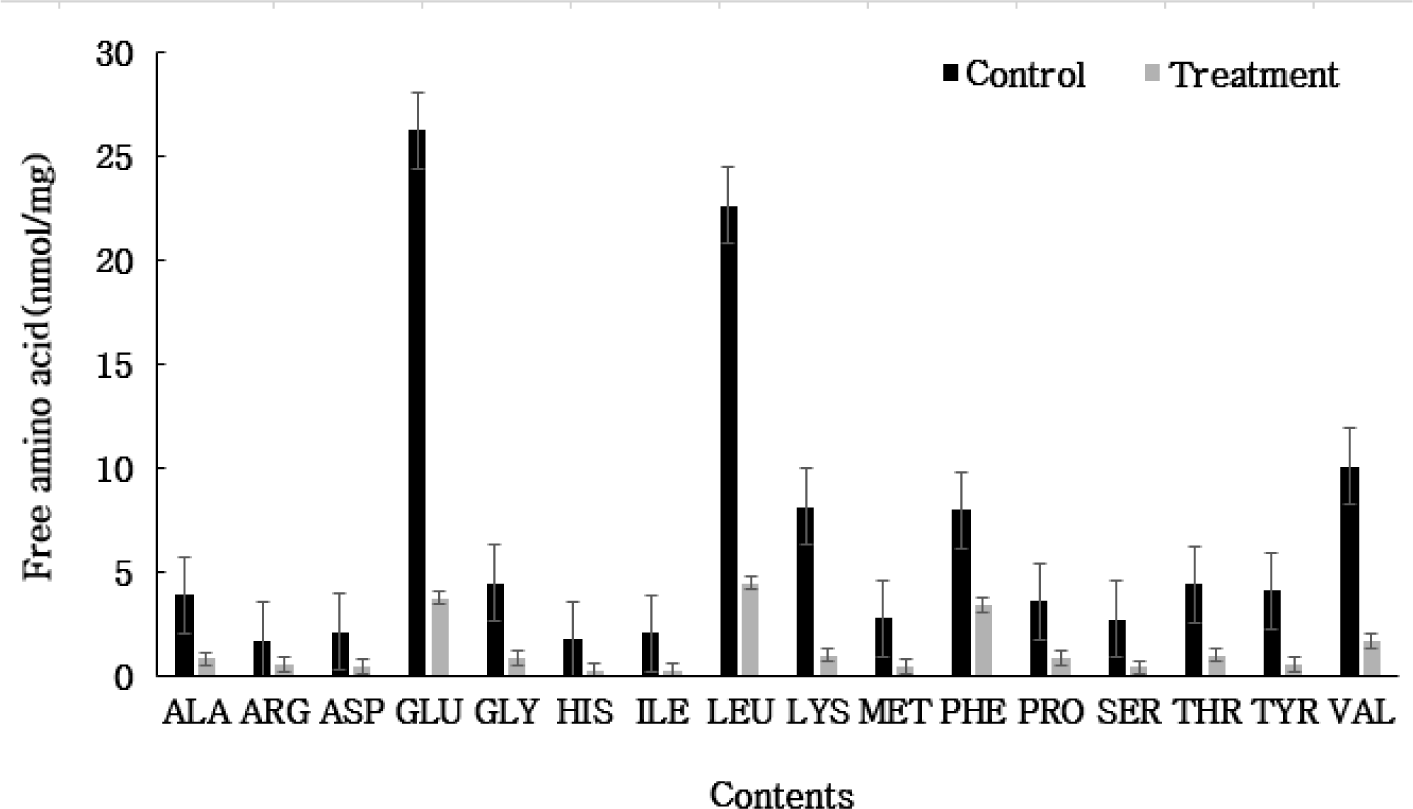
유리아미노산에 대한 결과는 Fig. 2와 같다. 대조구에서 methionine은 2.74 nmol/mg으로 측정되었고 첨가구에서는 0.43 nmol/mg로 측정되었다. 또한 leucine의 경우 대조구에서 22.61 nmol/mg, 첨가구에서 4.45 nmol/mg으로 나왔으며, valine는 대조구 10.07 nmol/mg, 첨가구1.65 nmol/mg으로 나타나 전체적으로 대조구가 다소 높은 값을 보였으나 유의적 차이는 없는 것으로 보였다. 치즈의 풍미에 영향을 주는 주요 아미노산으로는 cysteine, methionine, valine, phenylalanine, tyrosine, tryptophan 및 leucine으로 본 실험에서도 같은 아미노산이 측정된 것을 볼 수 있었다[9,10]. 특히 아미노산 중 leucine, isoleucine, valine 등이 치즈 특유의 풍미를 낸다[10,11]. 대조구, 첨가구에서 leucine, valine 등이 높은 값을 보임에 따라 아미노산의 주요 성분으로 인해 치즈의 풍미가 발달되었다고 사료된다. 본 연구에서는 leucine, valine 등 대조구가 첨가구에 비해서 다소 높은 값을 보였으나 큰 차이는 없는 것으로 보였으며 기존 상업적 균주에 보조균으로 사용 가능할 것으로 사료되었다.
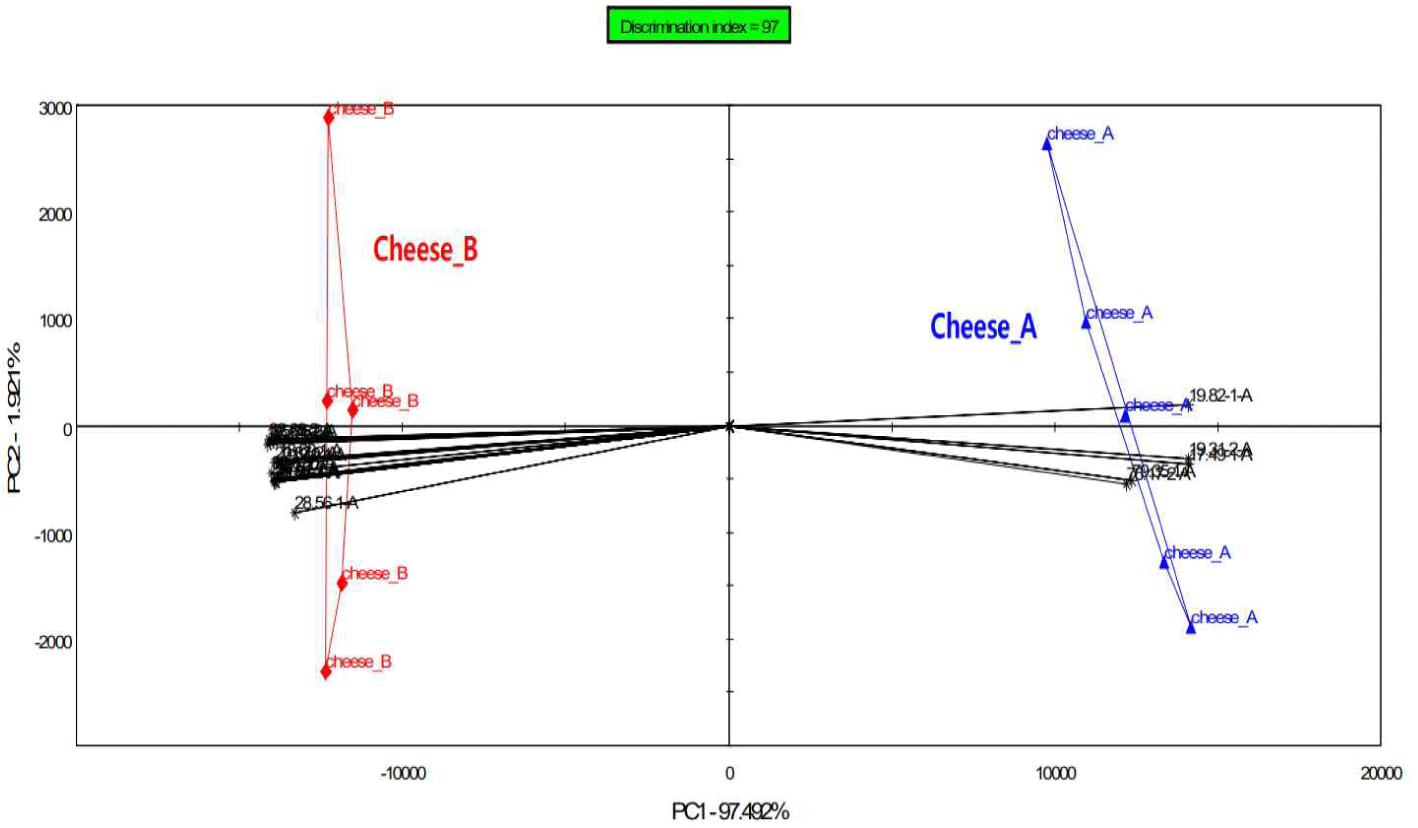
숙성된 체다치즈에 대한 전자코 분석에 대한 18개의 peak area값과 예상 성분 값 결과는 Table 3과 같고 각 시료에 대한 향기 패턴은 Fig. 3과 같다. 대조구와 첨가구에서 상대적으로 높은 값을 나타내는 성분은 상이했고 첨가구에서 높은 값을 나타낸 성분은 Ethanol, Pentane, Limonen, P-Cymene로 확인되었다. 대조구에서 높은 값을 나타낸 성분은 2-propanol, 1-propanol, Hexane, But-(E)-2-enal, 2-ethyl furan, 2-methylpropanoic acid, Butane-2,3-dione, Formic acid, 3-pentanol, Cyclohexanone로 확인되었다. 특히 Butane-2,3-dione은 대조구에서만 나타났는데, 이는 Butter, Caramelized, Fruity 등의 향 특성을 나타내 유의적 차이를 확인할 수 있었다. 주성분분석(PCA)을 통해 18개의 주요 휘발성 향기 성분과 그에 대한 각 시료의 향기 패턴은 PCA Discrimination Index 97로 2개 시료의 향기 패턴이 구분되며 시료 간 분포도를 가장 잘 설명하는 PC1의 설명력은 97.5% PC2의 설명력은 1.9%로 PC1의 설명력이 매우 높아 이를 기준으로 2개 시료가 구분된다. 향 차이가 나는 것은 첨가구와 상대적으로 높은 상관성을 나타내는 17.49(MXT-5)외 4개(Table 3의 3, 9, 10, 18) 향기성분과 대조구의 높은 상관성을 지니는 18.96(MXT-5)외 12개(Table 4의 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 16, 17) 향기 성분 때문으로 사료된다. 전자코를 이용하여 다양한 치즈의 향기 분석 결과로 주성분 분석에서 같은 영역에 분포할수록 치즈는 유사한 향 특성을 지니는 것으로 알려져 있으나, 대조구와 첨가구에서는 해당하는 영역이 없어 스타터로 인한 향미에는 차이가 있는 것으로 사료되었다[12].
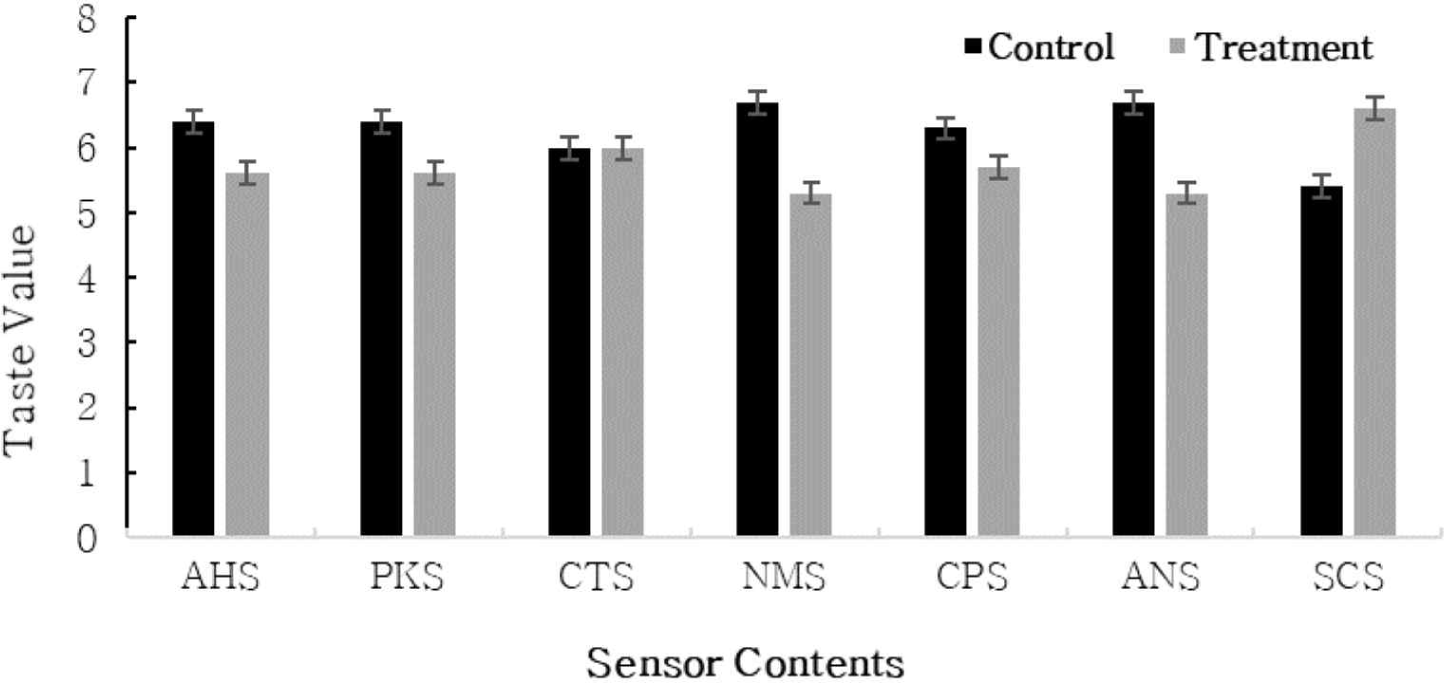
숙성된 체다치즈에 대한 전자혀를 이용하여 측정된 센서값을 맛 가치 값(Taster Value, 12점 척도)으로 변환하여 나타낸 값은 Fig. 4와 같다. 짠맛에 기여하는 CTS는 대조구, 첨가구 6.0으로 유의적 차이가 없었다. 신맛에 관여하는 AHS 센서에서 대조구가 6.4 첨가구가 5.6, 단맛을 대표하는 PKS 센서에서는 대조구가 6.4 첨가구가 5.6으로 상대적으로 대조구가 높은 값을 나타냈다. 감칠맛을 대표하는 NMS는 대조구 6.7 첨가구 5.3, 쓴맛에 관여하는 ANS에서는 대조구가 6.7 첨가구에서는 5.3으로 낮은 값을 나타냄에 따라 이는 대조구가 첨가구보다 더 풍부한 맛을 나타낸다고 사료되었다.
체다치즈에 대한 관능검사 결과는 Table 4와 같다. 치즈에 대한 외관은 첨가구와 대조구 모두 8.15로 같은 값을 보였고, 색감은 대조구 8.05 첨가구 8.12로 나타났다. 조직감은 대조구 8.43, 첨가구 8.17로 치즈 풍미는 대조구 8.88, 첨가구 8.21로 대조구가 다소 높은 값을 보였다. 외관과 색감, 전체적인 기호도에서는 대조구와 첨가구의 유의적 차이는 없는 것으로 나타났고, 조직감과 치즈 풍미에서는 대조구가 첨가구보다 다소 높은 값을 보였는데 이는 유리아미노산과 전자코, 전자혀의 결과 값과 유사한 것으로 숙성도에 따라 치즈의 조직과 풍미에 영향을 미치는 것으로 나타났다.
결 론
본 연구는 임실 소재 우리나라 최초의 숙성동굴에서 분리된 균주를 이용한 체다치즈 스타터로 현장적용이 가능한지에 대한 것이다. 연구에 사용된 선별균주는 L. lactis subsp. lactis(LL), L. lactis subsp. cremoris(LC), and S. thermophiles(ST)으로 3종을 선별하여 체다치즈를 제조하여 숙성하였다. 숙성기간별 품질특성을 비교한 결과 대조구와 첨가구의 pH는 5.3–5.4이었고, 유산균은 7.8×108 cfu/g, 1.7×108 cfu/g로 나타났으며 일반 성분 분석에서도 유의적 차이가 없는 것으로 나타났다. 숙성 과정 중 단백질 분해도를 나타내는 NPN, NCN 함량 모두 증가하는 것으로 나타났으며 특히 대조구가 첨가구에 비해 다소 높은 값을 보였다. 유리아미노산을 분석한 결과 향미를 나타내는 leucine은 첨가구보다 대조구에서 다소 높은 값을 보였고, valine는 대조구 10.07 nmol/mg, 첨가구 9.65 nmol/mg로 나타남에 따라 치즈 풍미가 대조구가 첨가구보다 풍부하다는것을 알 수 있었다. 전자코에서 2-propanol, 1-propanol, hexane, but-(E)-2-enal, 2-ethyl furan 등이 대조구에서 다소 높게 나타났고 butter, caramelized, fruity 등의 향 특성이 나타났으며 향기 분석 결과로 주성분 분석에서 같은 영역에 분포하지 않아 유의적 차이를 확인할 수 있었다. 전자혀를 이용한 센서값을 맛 가칫값으로 변화된 값에서는 신맛(AHS)과 단맛(PKS), 감칠맛(NMS)에서 대조구가 높은 값을 나타남에 따라 대조구가 첨가구보다 더 풍부한 맛을 나타낸다고 사료되었다. 관능검사 결과에서는 외관과 색감, 전체적인 기호도에서는 대조구와 첨가구의 유의적 차이는 없는 것으로 나타났고, 조직감과 치즈 풍미에서는 대조구가 첨가구보다 다소 높은 값을 보였는데 이는 유리아미노산과 전자코, 전자혀의 결과 값과 유사한 것으로 숙성도에 따라 치즈의 조직과 풍미에 영향을 미치는 것으로 나타났다. 이러한 결과를 바탕으로 선별균주 3종에 대해 보조균주로써 현장적용이 가능하며 향후 유산균 활력을 증진시키는 연구를 추가 진행함으로써 국내 유일 임실만의 치즈스타터 개발로 가능할 것으로 사료되었다.
