ARTICLE
β-Glucosidase 활성이 높은 유산균을 이용한 한국가시오갈피 발효 추출물의 Syringaresinol의 함량 및 MC3T3E1조골세포 분화 평가
Evaluation of Syringaresinol Content and MC3T3E1 Osteoblast Differentiation of Fermented Extracts of Eleutherococcus senticosus Using Lactobacillus ssp. with High β-Glucosidase Activity
Minji Kang
1
, Minkyoung Kang
1
, Sangnam Oh
1,*
1Department of Food and Nutrition, Jeonju University, Jeonju, Korea
*Corresponding author : Sangnam Oh, Department of Food and Nutrition, Jeonju University, Jeonju, Korea, Tel : +82-63-220-3109, Fax : +82-63-220-2054, E-mail :
osangnam@jj.ac.kr
© Copyright 2024, Korean Society of Dairy Science and Biotechnology. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Apr 23, 2024; Revised: May 26, 2024; Accepted: May 27, 2024
Published Online: Jun 30, 2024
Abstract
This study investigated the β-glucosidase activity of lactic acid bacteria and specifically eleutheroside E and B from Acanthopanax senticosus after bioconverting them into syringaresinol (SYR). Out of 125 lactic acid bacteria strains isolated from kimchi and other sources, 46 exhibiting both extracellular and internal β-glucosidase activity were identified. Notably, strains LFFR 20-011 (Lactobacillus curvatus) and LFFR 20-043/ LFR20-050 (Levilactobacillus brevis) enhanced SYR production by more than two-fold during Acanthopanax senticosus fermentation. Further investigation revealed that SYR significantly promoted osteoblast differentiation, as evidenced by the increased mRNA expression levels of early and mature osteoblast markers, including Runx2, type I collagen, and osteocalcin. These findings suggested that the enhanced presence of SYR through bioconversion by Acanthopanax senticosus may improve bone health. These results provide foundational data supporting the development of lactic-acid-bacteria-fermented Acanthopanax senticosus as a functional food aimed at promoting skeletal health in older adults.
Keywords: β-glucosidase; Acanthopanax senticosus; syringaresinol; osteoblast differentiation; bioconversion
서 론
가시오갈피(Acanthopanax senticosus)는 가시오갈피나무의 건조된 뿌리 및 뿌리줄기를 지칭하고, 한국, 중국, 일본, 러시아 등에서 재배되며, 만성 기관지염, 고혈압, 항스트레스, 위궤양 예방제 등 다양한 질병을 예방하는 것으로 잘 알려져 있다[1,2]. 가시오갈피는 lignans(eleutheroside E), acanthoside D, (–)-sesamine, syringaresinol diglucoside, friedelin, syringing, isofraxidin, phenolic glycoside, β-sitosterol 등 스테롤 및 페놀류 등 다양한 성분들이 확인되었다[3–6]. 이 중 eleutheroside B(EB)과 eleutheroside E(EE)는 배당체(glycoside) 형태[7,8]로 존재하는 활성성분으로써, 항우울효과[9,10], 피로 회복 및 스트레스에 대한 저항력[11,12]을 강화시킨다고 보고된바 있다. 가시오갈피의 기능성을 증진시키기 위해 상황버섯이나 버섯균사체를 첨가 발효물 제조하여 이에 대한 항산화 및 간손상 보호 효능을 제시되었으나[13,14], 가시오갈피의 특정 배당체의 증진을 타겟으로 하는 프로바이오틱스 균주의 발효에 대한 연구는 수행된 바가 없다. Syringaresinol(SYR)은 당이 결합되지 않은 화학적인 형태로써 EB와 EE에 비해 소량으로 존재하나, 인삼열매에서 추출한 SYR은 산화스트레스에 의한 피부노화 기능성 [15,16] 및 항염증[17,18] 등 다양한 효능이 보고되고 있어, 지속적인 효능연구를 통해 국내 자생특산물의 우수성이 입증되고 있다.
β-Glucosidase는 β-D-glucosidic 결합을 가수분해하는 효소로써 배당체 및 올리고당을 포함한 다양한 당접합체의 β-D-glucosyl 잔기를 분해하여 비당부분을 생성함으로써, 식품, 양조, 제약 및 화장품 산업에서 중요한 역할을 한다[19]. 예를 들어 β-glucosidase 효소 활성이 있는 Lactiplantibacillus plantarum GS100은 stevoiside를 rubusoside로 전환할 수 있기 때문에 저비용의 발효기술을 통해 유용물질인 rubusoside를 생산할 수 있어 생물전환기술(bioconversion)을 효과적으로 적용할 수 있으며[20], 원하는 활성 물질로 전환하기 위해 최적화된 프로바이오틱스를 선발하는 것이 필요하다.
이에 본 연구에서는 β-glucosidase 활성을 가진 프로바이오틱스를 선별하고 가시오갈피 추출물 발효를 통해 SYR 생성을 증진시킬 수 있는 능력을 확인하였고, SYR가 조골세포 분화를 촉진함을 밝힘으로써 새로운 기능성을 제시하고자 한다.
재료 및 방법
1. 유산균 분리 및 배양
11종류의 김치류(동치미, 고수, 무, 파, 갓, 오이, 열무, 겉절이, 1년산[배추 김치 숙성 1년], 2년산(배추 김치 숙성 2년), 김장 김치[배추])와 독일 발효 식품인 Sauerkaut로부터 총 125종의 유산균을 분리하였다. 유산균은 Lactobacilli MRS Broth(Difco, USA)를 사용하여 36℃에서 24시간 동안 정치 배양법을 적용하였다. 배양 완료된 유산균은 glycerol(Junsei Chemical, Japan)을 활용하여 –80℃에서 보관 가능한 stock 형태로 준비하였고, 이후 활성화 과정을 거쳐 본 연구에 활용하였다.
2. β-glucosidase 활성 균주 분리
0.3% esculin(Sigma-Aldrich, USA)과 0.02% ammonium ferric citrate(Sigma-Aldrich)가 첨가된 Lactobacilli MRS(Difco) 평판 배지에 균주를 접종하여 수행하였다. 10 μL의 LAB 배양액을 아가 플레이트의 지정된 구역에 접종하여, 37℃에서 48시간 배양하였다. 접종 부위 주변에서 검은 색의 환을 형성한 균주들은 β-glucosidase의 활성이 있음을 나타내는 것으로 간주되었다.
3. 세포 외 β-glucosidase 활성 측정
세포 외 효소 활성 측정을 위해 36℃에서 24시간 배양한 균주를 원심분리하여 상등액을 확보하였다. 기질 용액은 p-nitrophenyl-β-D-glucopyranoside(Sigma-Aldrich)를 sodium acetate/ acetic acid(Junsei Chemical) (50 mM, PH 5) 완충액에 5 mM이 되도록 용해하여 사용하였다. 기질 용액 30 μL에 균주에서 분리한 상등액을 30 μL 첨가하여 37℃에 10분간 반응한 후, 0.5 M의 sodium carbonate(Sigma-Aldrich)를 사용하여 효소반응을 정지시켰다. 생성된 p-nitrophenol 농도는 410 nm에서의 흡광도를 측정하였고, 효소 활성은 37℃와 pH 5의 조건에서 1분 동안 1 μmol의 p-nitrophenol을 생성하는 효소의 양으로써 나타내었다.
4. 세포 내 β-glucosidase 활성 측정
세포 내 효소 활성을 위해 36℃에서 24시간 배양한 균주를 원심분리하여 얻은 pellet에 700 μL의 50 mM, pH 5 sodium acetate/acetic acid, Junsei Chemical) 완충액을 넣은 후 0.2 mm stainless bead 0.25 g을 주입하여 균질기(taco™Prep Bead Beater, Taiwan)를 이용해 3분 동안 파쇄하였다. 16,000×g에서 4℃, 15분의 조건으로 원심분리를 실시하여 상등액을 얻은 후, 세포 외 효소활성 측정 방법을 사용하였다.
5. 가시오갈피 추출발효물 제조 및 HPLC를 이용한 추출물의 syringaresinol 함량 측정
β-glucosidase 양성 유산균의 SYR 생성 효과를 확인하기 위해 2%, 5% 가시오갈피 분말이 포함된 MRS 배지를 준비하고, autoclave를 사용해 고압멸균을 진행하였다. 가시오갈피 분말을 함유하고 있는 MRS 배지에 1%로 접종한 후 36℃, 3일, 5일 동안 정치배양하였다. 배양 후 원심분리(2,000 ×g, 4℃, 10분)하여 상등액을 취한 후, 고성능 액체크로마토그래피(high-performance liquid chromatography, HPLC; Agilent 1100 Series, Agilent Technologies, USA)를 활용하여 Zhao등의 방법에 따라 SYR 의 함량을 분석하였다[21]. 컬럼은 Capcell Pak(C18, 5 μM, 4.6×250 mm; Shiseido, Japan)를 이용하였으며, 컬럼의 온도는 30℃로 설정하고, 이동상의 조성은 acetonitrile 10%(0분), 20%(8분), 30%(13분), 70%(20분), 유속은 1.0 mL/min로 유지하였으며, 시료주입량은 10 μL로 하였다. 크로마토그램은 UV 디텍터(UV/Vis Waters 2487 Dual λ, Absorbance Detector, USA)를 이용하여 220 nm 파장에서 검출되었다.
6. MC3T3-E1 세포 배양, 생존률 및 분화 유도
마우스 유래 조골세포 MC3T3-E1를 α-minimum essential medium(α-MEM, no ascorbic acid, Gibco, USA)에 10% fetal bovine serum(FBS, Gibco) 및 항생제 1% penicillin-streptomycin(Gibco)을 첨가하여 37℃, 5% CO2 조건의 습윤 배양기에서 배양하였다. 배지는 세포가 70%–80%에 이를 때까지 2–3일마다 교체되었다. MC3T3-E1 조골세포에 대한 SYR 의 세포 증식 또는 독성 평가를 관찰하기 위해 96 well plate에 2×104 /cm2 농도로 접종하여, 37℃, 5% CO2 습윤 배양기에서 24시간 배양한 후 SYR 1, 2.5, 5, 10, 50, 100 μM를 첨가하여 24 및 48시간 동안 배양하였으며, 세포독성평가는 tetrazolium compound [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt] MTS 분석으로 측정하였다. 제조사의 프로토콜에 따라 10 μL EZ-Cytox(Dogenbio, Korea)을 각 well에 첨가하여 2시간 배양하여 반응시킨 후, plate reader(Synergy HTX, Biotek Instruments, USA)를 이용하여 450 nm에서 흡광도를 측정하였다. 조골세포 분화 및 석회화를 유도하기 위해 성장배지에 50 μg/ mL ascorbic acid 와 5 mM β-glycerol phosphate 을 첨가한 분화배지를 제조하여 2일 간격으로 교체하며 7일 동안 분화를 유도했다.
7. Alkaline phosphatase (ALP) staining
MC3T3-E1 조골세포에 대한 SYR의 분화 및 석회화를 관찰하기 위해 alkaline phosphatase 염색을 시행하였다. 세포를 24 well plate에 2×104 /cm2 농도로 접종하여 37℃, 5% CO2 습윤 배양기에서 24시간 배양한 후, 분화배지와 함께 SYR 을 처리하여 분화 유도 7일 후에 각 실험군의 세포를 PBS로 3회 세척한 후 4% paraformaldehyde로 1분간 고정하였다. PBS로 2번 세척한 후, 2h 동안 멸균 증류수에서 BCIP/NBT tablet(BCIP-NBT; B5655, Sigma-Aldrich)을 녹여 제조한 solution을 세포에 첨가하여 10분 동안 암실에서 반응하였다. 반응이 끝나면 BCIP/NBT solution을 제거하고 0.05% Tween-20을 포함한 PBS을 첨가하여 현미경을 통해 세포 색의 변화를 관찰하였다. MC3T3-E1 세포의 분화 유무를 확인하기 위하여 미분화 대조군(control)을 함께 관찰하였다.
8. Real-time quantitative PCR 분석
MC3T3-E1 조골세포를 분화배지와 함께 SYR을 1, 3, 7일 동안 처리하여 세포의 RNA 추출을 위해 PBS로 세척한 후 QIAzol lysis reagent(Qiagen, Germany)를 이용하여 total RNA를 추출하였다. RNA 농도는 BioTek Take 3 plate reader(Biotek Instruments)를 이용하여 농도와 순도를 확인하였다. 추출된 RNA는 cDNA 합성을 위하여 1 μg의 total RNA를 reverse-transcriptase와 oligo(dT) primer를 이용한 cDNA synthesis kit(Biorad)를 이용하여 역전사 반응을 시행하였다. 합성된 cDNA는 100 ng의 농도로 희석하여 1 μL에 Luna® Universal qPCR Master Mix(NEB, USA) 5 μL, 표적 유전자 프라이머를 forward/reverse 각각 1 μL 넣고 전체 부피가 10 μL 되도록 nuclease free water로 처리한 후 중합효소연쇄반응(real-time polymerase chain reaction, RT-qPCR)을 시행하였다. 반응 조건은 95℃에서 10분, 변성(denaturation) 반응을 95℃에서 30초, 결합(annealing) 반응을 60℃에서 30초, 72℃에서 30초간 40주기를 반복하였다. 정량을 위한 대조군(house-keeping gene)은 GAPDH를 이용하였다. 프라이머 서열(primer sequence)은 Table 1과 같다.
Table 1.
Primers used in this study for qRT-PCR
|
Primer |
Sequence (5’-3’) |
|
OCN |
Forward: CAGCGGCCCTGAGTCTGA |
|
Reverse: GCCGGAGTCTGTTCACTACCTTA |
|
Runx2 |
Forward: CGCCCCTCCCTGAACTCT |
|
Reverse: TGCCTGCCTGGGATCTGTA |
|
Type I COL |
Forward: GTGAGACAGGCGAACAAG |
|
Reverse: CAGGAGAACCAGGAGGAC |
|
GAPDH |
Forward: TCTCCTGCGACTTCAACA |
|
Reverse: CTGTAGCCGTATTCATTGTC |
Download Excel Table
9. 통계 분석
세포 실험 데이터는 평균과 표준편차로 나타내었으며, 각 실험군 간 유의성에 대한 통계적 분석은 Two-way ANOVA 후에 Šídák's multiple comparisons test에 의해 실시하였고, p<0.05의 값은 통계적 유의성을 나타내는 것으로 간주되었다.
결 과
1. 전통발효식품 유래 균주 분리 및 β-glucosidase 활성 균주 선별
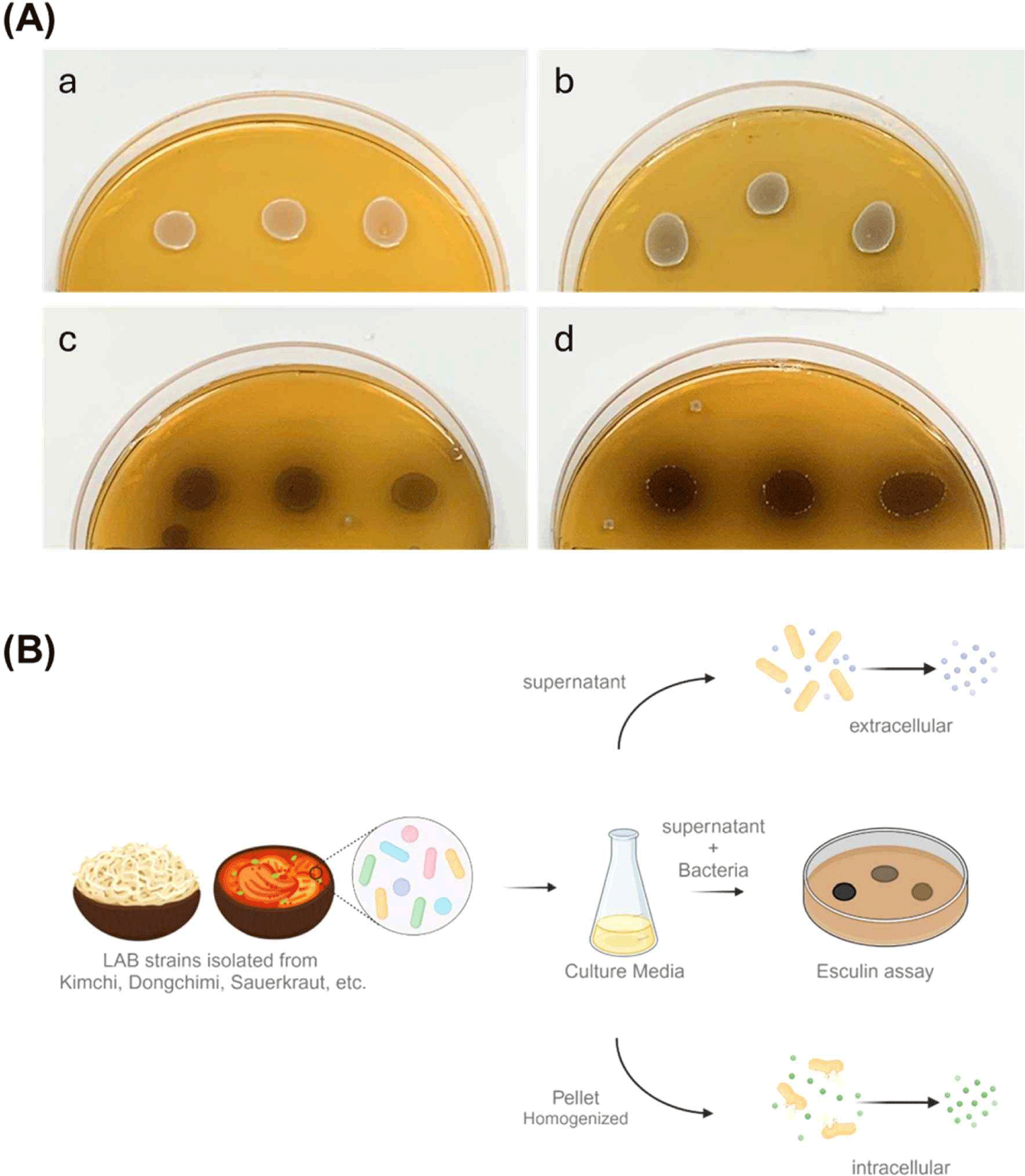
가시오갈피 발효 적합 유산균 분리를 위해 다양한 제조 방식으로 만들어진 숙성된 김치를 수집하여 시료로 사용하였다. 수집된 각 시료는 단계적으로 희석하여 MRS 고체 배지에 접종한 후, 각각의 집락 형태와 색상 등이 상이한 125개를 분리하였으며, β-glucosidase 활성을 가지고 있는 균주를 선별하기 위한 유산균 후보 소재로 활용하였다(Table 2). β-Glucosidase 활성이 있는 균주를 1차적으로 선별하기 위해 esculine을 첨가한 MRS 고체 배지를 사용하여 활성을 평가한 결과, 균주에 따라 환의 진하기와 배지의 색 변화가 다르게 나타났으며, 36.8%에 해당하는 46개의 균주에서 β-glucosidase 활성이 관찰되었다(Fig. 1A, Table 3).
Table 2.
Isolation and cultivation of lactic acid bacteria from fermented foods
|
No. |
Sources |
Strain ID |
Strain |
Culture condition |
|
Time (h) |
Temp (°C) |
|
1 |
Dongchimi |
LFR19_001 |
Latilatilactobacillus sakei
|
48 |
37 |
|
2 |
Dongchimi |
LFR19_002 |
Latilactobacillus sakei
|
48 |
37 |
|
3 |
Dongchimi |
LFR19_003 |
Latilatilactobacillus sakei
|
48 |
37 |
|
4 |
Dongchimi |
LFR19_004 |
Latilactobacillus sakei
|
48 |
37 |
|
5 |
Dongchimi |
LFR19_005 |
Latilactobacillus sakei
|
48 |
37 |
|
6 |
Dongchimi |
LFR19_006 |
Latilactobacillus sakei
|
48 |
37 |
|
7 |
Dongchimi |
LFR19_007 |
Latilactobacillus sakei
|
48 |
37 |
|
8 |
Dongchimi |
LFR19_008 |
Latilactobacillus sakei
|
48 |
37 |
|
9 |
Dongchimi |
LFR19_009 |
Latilactobacillus sakei
|
48 |
37 |
|
10 |
Dongchimi |
LFR19_010 |
Latilactobacillus sakei
|
48 |
37 |
|
11 |
Dongchimi |
LFR19_011 |
Latilactobacillus sakei
|
48 |
37 |
|
12 |
Dongchimi |
LFR19_012 |
Latilactobacillus sakei
|
48 |
37 |
|
13 |
Dongchimi |
LFR19_013 |
Latilactobacillus sakei
|
48 |
37 |
|
14 |
Dongchimi |
LFR19_014 |
Latilactobacillus sakei
|
48 |
37 |
|
15 |
Dongchimi |
LFR19_015 |
Latilactobacillus sakei
|
48 |
37 |
|
16 |
Dongchimi |
LFR19_016 |
Latilactobacillus sakei
|
48 |
37 |
|
17 |
Dongchimi |
LFR19_017 |
Latilactobacillus sakei
|
48 |
37 |
|
18 |
Dongchimi |
LFR19_018 |
Latilactobacillus sakei
|
48 |
37 |
|
19 |
Dongchimi |
LFR19_019 |
Staphylococcus haemolyticus
|
48 |
37 |
|
20 |
Dongchimi |
LFR19_020 |
Latilactobacillus sakei
|
48 |
37 |
|
21 |
Dongchimi |
LFR19_021 |
Latilactobacillus sakei
|
48 |
37 |
|
22 |
Dongchimi |
LFR19_022 |
Latilactobacillus sakei
|
48 |
37 |
|
23 |
Dongchimi |
LFR19_023 |
Latilactobacillus sakei
|
48 |
37 |
|
24 |
Dongchimi |
LFR19_024 |
Staphylococcus hominis
|
48 |
37 |
|
25 |
Dongchimi |
LFR19_025 |
Latilactobacillus sakei
|
48 |
37 |
|
26 |
Dongchimi |
LFR19_026 |
Latilactobacillus sakei
|
48 |
37 |
|
27 |
Dongchimi |
LFR19_027 |
Latilactobacillus sakei
|
48 |
37 |
|
28 |
Dongchimi |
LFR19_028 |
Latilactobacillus sakei
|
48 |
37 |
|
29 |
Dongchimi |
LFR19_029 |
Leuconostoc mesenteroides
|
48 |
37 |
|
30 |
Dongchimi |
LFR19_030 |
Latilactobacillus sakei
|
48 |
37 |
|
31 |
Dongchimi |
LFR19_031 |
Latilactobacillus sakei
|
48 |
37 |
|
32 |
Dongchimi |
LFR19_032 |
Latilactobacillus sakei
|
48 |
37 |
|
33 |
Coriander Kimchi |
LFR20-001 |
Latilactobacillus sakei
|
48 |
37 |
|
34 |
Radish Kimchi |
LFR20-002 |
Levilactobacillus brevis
|
48 |
37 |
|
35 |
Green onion kimchi |
LFR20-003 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
36 |
Green onion kimchi |
LFR20-004 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
37 |
Leaf mustard kimchi |
LFR20-005 |
Latilactobacillus sakei
|
48 |
37 |
|
38 |
Leaf mustard kimchi |
LFR20-006 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
39 |
Cucumber Kimchi |
LFR20-007 |
Latilactobacillus sakei
|
48 |
37 |
|
40 |
Cucumber Kimchi |
LFR20-008 |
Levilactobacillus brevis
|
48 |
37 |
|
41 |
2 year Kimchi |
LFR20-009 |
Levilactobacillus brevis
|
48 |
37 |
|
42 |
2 year Kimchi |
LFR20-010 |
Leuconostoc mesenteroides
|
48 |
37 |
|
43 |
Young radish Kimchi |
LFR20-011 |
Lactobacillus curvatus
|
48 |
37 |
|
44 |
Young radish Kimchi |
LFR20-012 |
Latilactobacillus sakei
|
48 |
37 |
|
45 |
Coriander Kimchi |
LFR20-013 |
Weissella viridescens
|
48 |
37 |
|
46 |
Coriander Kimchi |
LFR20-014 |
Weissella viridescens
|
48 |
37 |
|
47 |
Coriander Kimchi |
LFR20-015 |
Latilactobacillus sakei
|
48 |
37 |
|
48 |
Coriander Kimchi |
LFR20-016 |
Latilactobacillus sakei
|
48 |
37 |
|
49 |
Green onion kimchi |
LFR20-017 |
Latilactobacillus sakei
|
48 |
37 |
|
50 |
Green onion kimchi |
LFR20-018 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
51 |
Green onion kimchi |
LFR20-019 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
52 |
Green onion kimchi |
LFR20-020 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
53 |
Green onion kimchi |
LFR20-021 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
54 |
Green onion kimchi |
LFR20-022 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
55 |
Green onion kimchi |
LFR20-023 |
Levilactobacillus brevis
|
48 |
37 |
|
56 |
Leaf mustard kimchi |
LFR20-024 |
Latilactobacillus sakei
|
48 |
37 |
|
57 |
Leaf mustard kimchi |
LFR20-025 |
Latilactobacillus sakei
|
48 |
37 |
|
58 |
Leaf mustard kimchi |
LFR20-026 |
Latilactobacillus sakei
|
48 |
37 |
|
59 |
Leaf mustard kimchi |
LFR20-027 |
Latilactobacillus sakei
|
48 |
37 |
|
60 |
Leaf mustard kimchi |
LFR20-028 |
Latilactobacillus sakei
|
48 |
37 |
|
61 |
Leaf mustard kimchi |
LFR20-029 |
Latilactobacillus sakei
|
48 |
37 |
|
62 |
Leaf mustard kimchi |
LFR20-030 |
Lacticaseibacillus rhamnosus
|
48 |
37 |
|
63 |
Leaf mustard kimchi |
LFR20-031 |
Latilactobacillus sakei
|
48 |
37 |
|
64 |
Leaf mustard kimchi |
LFR20-032 |
Latilactobacillus sakei
|
48 |
37 |
|
65 |
Leaf mustard kimchi |
LFR20-033 |
Latilactobacillus sakei
|
48 |
37 |
|
66 |
Geotjeori |
LFR20-034 |
Latilactobacillus sakei
|
48 |
37 |
|
67 |
Cucumber Kimchi |
LFR20-035 |
Levilactobacillus brevis
|
48 |
37 |
|
68 |
Cucumber Kimchi |
LFR20-036 |
Leuconostoc mesenteroides
|
48 |
37 |
|
69 |
Cucumber Kimchi |
LFR20-037 |
Levilactobacillus brevis
|
48 |
37 |
|
70 |
1 year Kimchi |
LFR20-038 |
Levilactobacillus brevis
|
48 |
37 |
|
71 |
2 year Kimchi |
LFR20-039 |
Levilactobacillus brevis
|
48 |
37 |
|
72 |
2 year Kimchi |
LFR20-040 |
Levilactobacillus brevis
|
48 |
37 |
|
73 |
2 year Kimchi |
LFR20-041 |
Levilactobacillus brevis
|
48 |
37 |
|
74 |
2 year Kimchi |
LFR20-042 |
Levilactobacillus brevis
|
48 |
37 |
|
75 |
2 year Kimchi |
LFR20-043 |
Levilactobacillus brevis
|
48 |
37 |
|
76 |
2 year Kimchi |
LFR20-044 |
Levilactobacillus brevis
|
48 |
37 |
|
77 |
2 year Kimchi |
LFR20-045 |
Levilactobacillus brevis
|
48 |
37 |
|
78 |
2 year Kimchi |
LFR20-046 |
Levilactobacillus brevis
|
48 |
37 |
|
79 |
2 year Kimchi |
LFR20-047 |
Levilactobacillus brevis
|
48 |
37 |
|
80 |
2 year Kimchi |
LFR20-048 |
Levilactobacillus brevis
|
48 |
37 |
|
81 |
2 year Kimchi |
LFR20-049 |
Levilactobacillus brevis
|
48 |
37 |
|
82 |
2 year Kimchi |
LFR20-050 |
Levilactobacillus brevis
|
48 |
37 |
|
83 |
Kimchi |
LFR20-051 |
Latilactobacillus sakei
|
48 |
37 |
|
84 |
Kimchi |
LFR20-052 |
Latilactobacillus sakei
|
48 |
37 |
|
85 |
Kimchi |
LFR20-053 |
Lactobacillus curvatus
|
48 |
37 |
|
86 |
Sausauerkraut |
LFR21-011 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
87 |
Sausauerkraut |
LFR21-012 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
88 |
Sausauerkraut |
LFR21-016 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
89 |
Sausauerkraut |
LFR21-018 |
Lactobacillus pentosus
|
48 |
37 |
|
90 |
Sausauerkraut |
LFR21-021 |
Lactobacillus pentosus
|
48 |
37 |
|
91 |
Sausauerkraut |
LFR21-022 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
92 |
Sausauerkraut |
LFR21-023 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
93 |
Sausauerkraut |
LFR21-024 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
94 |
Sausauerkraut |
LFR21-027 |
Lactobacillus pentosus
|
48 |
37 |
|
95 |
Sausauerkraut |
LFR21-028 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
96 |
Sausauerkraut |
LFR21-031 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
97 |
Sausauerkraut |
LFR21-032 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
98 |
Sausauerkraut |
LFR21-033 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
99 |
Sausauerkraut |
LFR21-045 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
100 |
Sausauerkraut |
LFR21-047 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
101 |
Sausauerkraut |
LFR21-048 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
102 |
Sausauerkraut |
LFR21-049 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
103 |
Sausauerkraut |
LFR21-057 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
104 |
Sausauerkraut |
LFR21-058 |
Levilactobacillus brevis
|
48 |
37 |
|
105 |
Sausauerkraut |
LFR21-060 |
Levilactobacillus brevis
|
48 |
37 |
|
106 |
Sausauerkraut |
LFR21-073 |
Levilactobacillus brevis
|
48 |
37 |
|
107 |
Dongchimi |
LFR21-081 |
Levilactobacillus brevis
|
48 |
37 |
|
108 |
Dongchimi |
LFR21-086 |
Levilactobacillus brevis
|
48 |
37 |
|
109 |
Dongchimi |
LFR21-088 |
Levilactobacillus brevis
|
48 |
37 |
|
110 |
Dongchimi |
LFR21-089 |
Levilactobacillus brevis
|
48 |
37 |
|
111 |
Dongchimi |
LFR21-090 |
Levilactobacillus brevis
|
48 |
37 |
|
112 |
Dongchimi |
LFR21-091 |
Levilactobacillus brevis
|
48 |
37 |
|
113 |
Dongchimi |
LFR21-092 |
Levilactobacillus brevis
|
48 |
37 |
|
114 |
Dongchimi |
LFR21-097 |
Levilactobacillus brevis
|
48 |
37 |
|
115 |
Dongchimi |
LFR21-099 |
Levilactobacillus brevis
|
48 |
37 |
|
116 |
Dongchimi |
LFR21-111 |
Levilactobacillus brevis
|
48 |
37 |
|
117 |
Dongchimi |
LFR21-114 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
118 |
Dongchimi |
LFR21-115 |
Lactiplantibacillus plantarum
|
48 |
37 |
|
119 |
Dongchimi |
LFR21-118 |
Levilactobacillus brevis
|
48 |
37 |
|
120 |
Dongchimi |
LFR21-121 |
Levilactobacillus brevis
|
48 |
37 |
|
121 |
Dongchimi |
LFR21-122 |
Levilactobacillus brevis
|
48 |
37 |
|
122 |
Dongchimi |
LFR21-123 |
Levilactobacillus brevis
|
48 |
37 |
|
123 |
Dongchimi |
LFR21-124 |
Levilactobacillus brevis
|
48 |
37 |
|
124 |
Dongchimi |
LFR21-126 |
Levilactobacillus brevis
|
48 |
37 |
|
125 |
Dongchimi |
LFR21-127 |
Levilactobacillus brevis
|
48 |
37 |
Download Excel Table
Fig. 1.
Screening for β-glucosidase activity in lactic acid bacteria isolates. (A) Evaluation of β-glucosidase activity in bacterial isolates cultured for 24 and 48 hours on MRS Agar supplemented with esculin (a, no activity; b, + low activity; c, ++ moderate activity; d, +++ high activity). (B) A diagrammatic representation of the protocol for isolating lactic acid bacteria strains exhibiting β-glucosidase activity.
Download Original Figure
Table 3.
Esculin agar screening results for β-glucosidase activity in lactic acid bacteria
|
No. |
Strain ID |
Culture condition |
LAB count (Log CFU/mL) |
|
Time (h) |
Temp (°C) |
|
1 |
LFR20-001 |
+ |
+ |
9.46 |
|
2 |
LFR20-002 |
+ |
+ |
9.50 |
|
3 |
LFR20-009 |
++ |
++ |
9.21 |
|
4 |
LFR20-011 |
+ |
+ |
9.53 |
|
5 |
LFR20-012 |
+ |
+ |
9.40 |
|
6 |
LFR20-023 |
++ |
++ |
9.49 |
|
7 |
LFR20-033 |
++ |
++ |
8.99 |
|
8 |
LFR20-038 |
+ |
+ |
9.29 |
|
9 |
LFR20-041 |
+++ |
+++ |
9.59 |
|
10 |
LFR20-042 |
+++ |
+++ |
9.62 |
|
11 |
LFR20-043 |
++ |
+ |
8.56 |
|
12 |
LFR20-045 |
+++ |
+++ |
8.43 |
|
13 |
LFR20-046 |
+++ |
++ |
9.32 |
|
14 |
LFR20-047 |
+++ |
+++ |
9.19 |
|
15 |
LFR20-048 |
++++ |
+++ |
9.20 |
|
16 |
LFR20-050 |
+ |
+ |
9.40 |
|
17 |
LFR20-051 |
+++ |
++ |
9.67 |
|
18 |
LFR20-052 |
+++ |
++ |
9.22 |
|
19 |
LFR20-053 |
++++ |
+++ |
8.18 |
|
20 |
LFR21-012 |
+ |
+ |
9.33 |
|
21 |
LFR21-016 |
+ |
+ |
8.06 |
|
22 |
LFR21-021 |
+ |
+ |
8.84 |
|
23 |
LFR21-023 |
+ |
++ |
8.02 |
|
24 |
LFR21-024 |
+ |
+ |
9.33 |
|
25 |
LFR21-033 |
+ |
+ |
8.35 |
|
26 |
LFR21-045 |
+ |
+ |
9.57 |
|
27 |
LFR21-047 |
++ |
+ |
8.29 |
|
28 |
LFR21-057 |
+ |
+ |
9.58 |
|
29 |
LFR21-058 |
++ |
++ |
8.22 |
|
30 |
LFR21-060 |
++ |
++ |
8.65 |
|
31 |
LFR21-073 |
+ |
+ |
8.58 |
|
32 |
LFR21-081 |
+ |
+ |
9.22 |
|
33 |
LFR21-086 |
++ |
++ |
9.51 |
|
34 |
LFR21-088 |
++ |
++ |
9.09 |
|
35 |
LFR21-089 |
+ |
+ |
9.27 |
|
36 |
LFR21-090 |
+ |
+ |
9.48 |
|
37 |
LFR21-092 |
+ |
+ |
9.36 |
|
38 |
LFR21-097 |
+ |
+ |
9.54 |
|
39 |
LFR21-111 |
+ |
++ |
9.50 |
|
40 |
LFR21-114 |
+ |
++ |
9.24 |
|
41 |
LFR21-118 |
+ |
++ |
9.41 |
|
42 |
LFR21-121 |
+ |
++ |
9.53 |
|
43 |
LFR21-122 |
+ |
++ |
9.23 |
|
44 |
LFR21-123 |
+ |
+ |
9.41 |
|
45 |
LFR21-124 |
+++ |
++ |
9.36 |
|
46 |
LFR21-126 |
+++ |
++ |
9.31 |
Download Excel Table
2. β-glucosidase 효소 활성
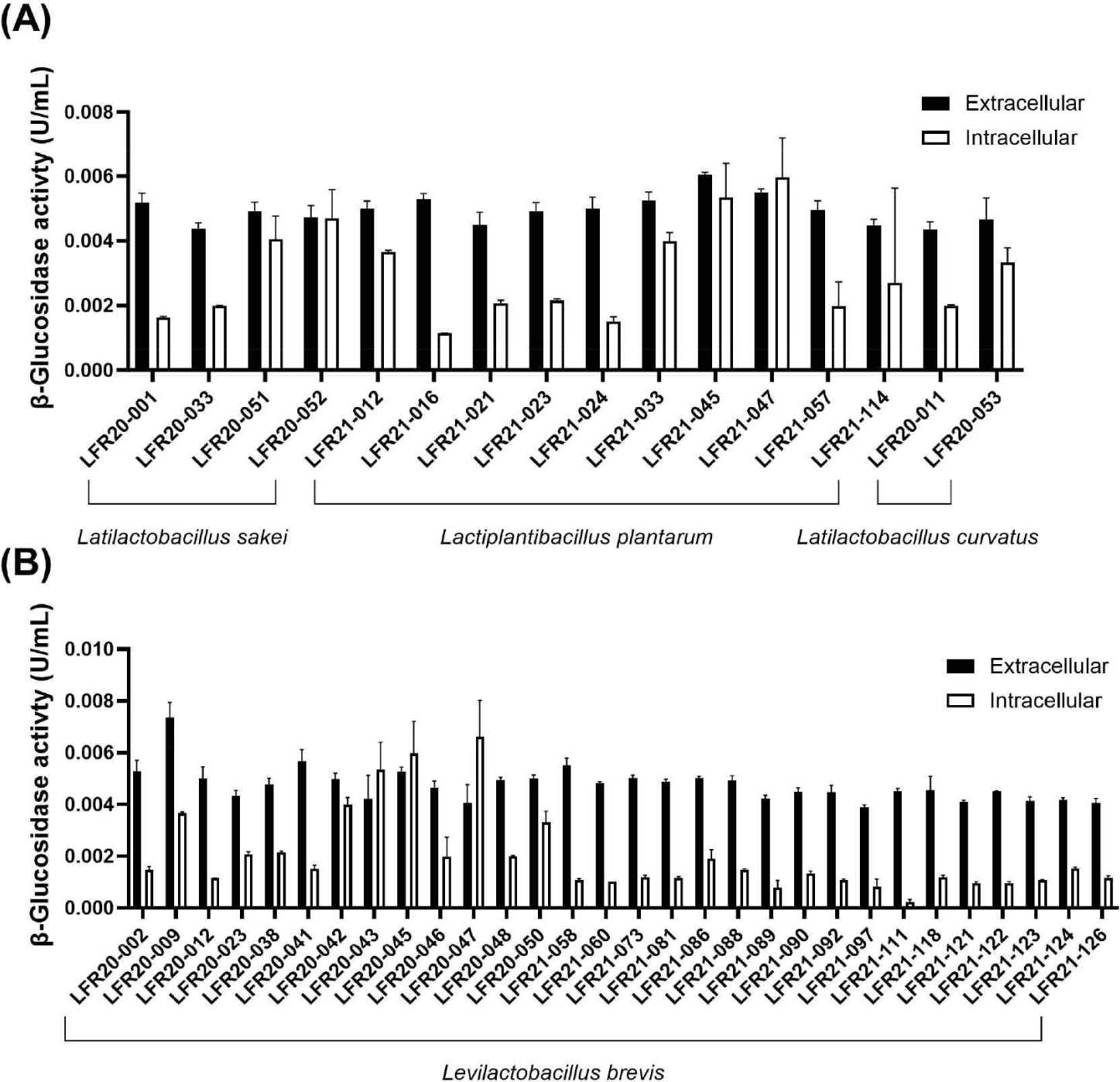
1차적으로 선별한 46종 균주를 대상으로 β-glucosidase 효소 활성을 측정하였다. 효소 활성은 37℃와 pH 5의 조건에서 1분 동안 1 μmol의 p-nitrophenol을 생성하는 효소의 양으로써 나타내었으며, 전반적으로 세포 외 β-glucosidase 효소 활성이 세포 내 활성보다 높은 경향을 보였다. 이는 β-glucosidase 효소적 기능이 세포 외 환경에서 더 활발하게 이루어질 수 있음을 확인할 수 있으며, 특히, 2020년도에 김치에서 분리된 Lacticaseibacillus brevis LFR20-009 균주는 세포 외 β-glucosidase 효소 활성이 0.00735 U/mL로 세포 내 결과 중 가장 높은 효소 활성을 나타내었고, 세포 내 β-glucosidase 효소 활성이 가장 큰 균주는 L. brevis LFR20-046으로 0.00611 U/mL로 나타났다(Fig. 2B). 분석한 유산균들은 Lacticaseibacillus curvatus, Lactiplantibacillus plantarum, Levilactobacillus brevis, L. casei 총 4종으로, β-glucosidase 효소 활성을 비교한 결과, 균주 종류에 따른 활성 차이는 크게 나타나지 않았다(Fig. 2). β-Glucosidase 효소 활성이 균주의 종류에 따른 차이는 크게 영향이 없음을 암시한다.
Fig. 2.
Measurement of β-glucosidase enzymatic activity in 46 selected LAB strains. (A) Representation of extracellular and intracellular β-glucosidase activities in strains corresponding to Latilatilactobacillus sakei, Lactiplantibacillus plantarum, and Latilactobacillus curvatus. (B) Representation of extracellular and intracellular β-glucosidase activities in strains corresponding to Levilactobacillus brevis.
Download Original Figure
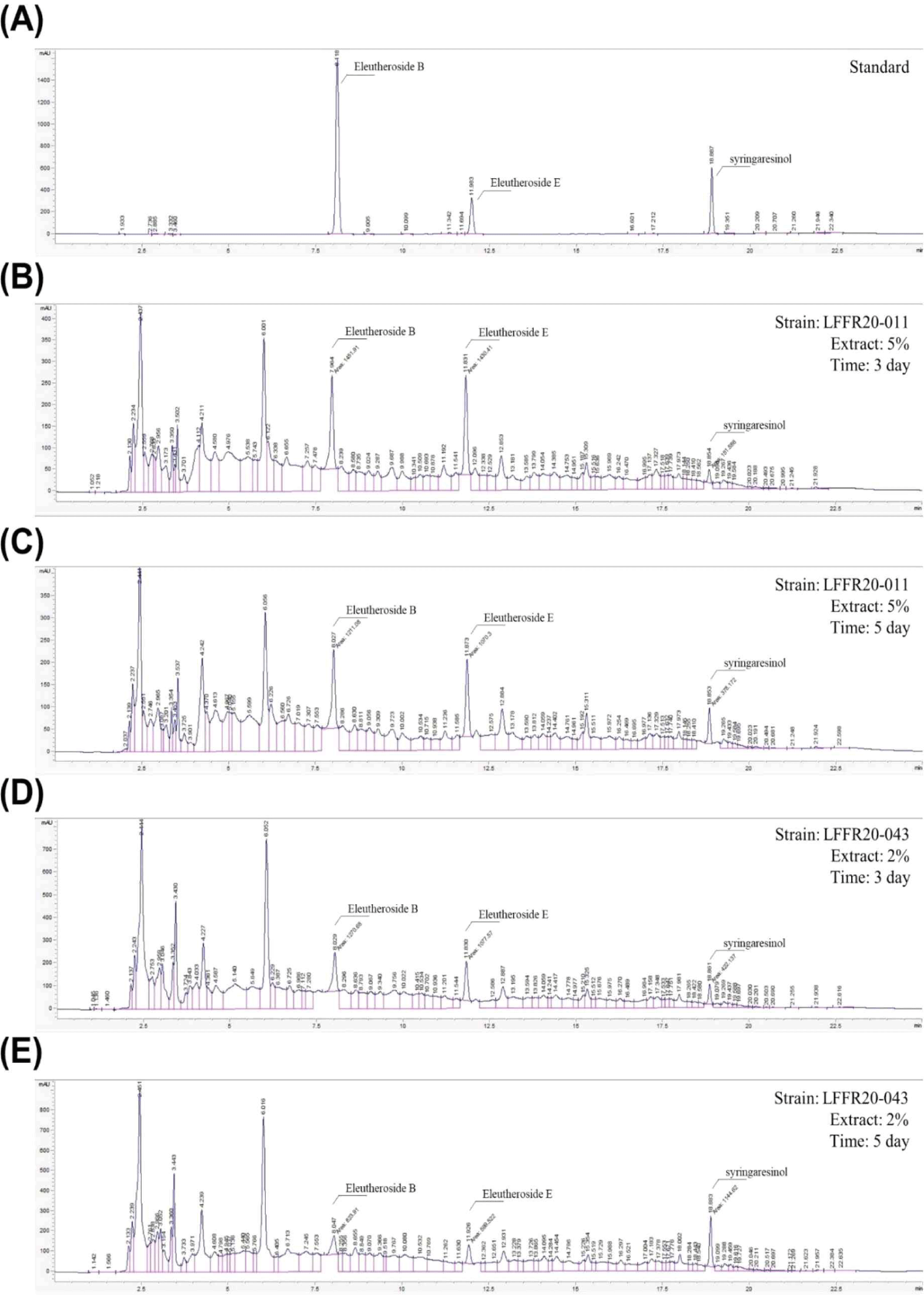
3. Syringaresinol 생성 확인
가시오갈피 분말을 2% 및 5% 농도로 함유된 MRS를 사용하여 선별된 46종의 균주로 3일, 5일간 발효를 진행 후에 각 유산균의 가시오가피 발효물에서 EE, EB, 및 SYR의 농도를 분석한 결과, LFR20-001, LFR20-002, LFR20-011, LFR20-012, LFR20-43 LFR 20-048, LFR20-050, LFR21-073 균주에서 SYR 생성이 확인되었다. 8종을 제외한 나머지 균주에서는 syringaresinol 농도가 매우 낮아 분석에서 제외되었으며, SYR 생성이 확인된 균주들은 시간이 증가함에 따라, 5일 발효 추출물에서 EB와 EE의 농도가 감소하는 경향을 확인할 수 있었다. 특히 LFFR20-011 및 LFR20-043 균주에서는 SYR 농도가 다른 균주에 비해 상당히 증가된 것이 관찰되었다(Table 4).
Table 4.
Quantification of eleutheroside B (EB), eleutheroside E (EE), and syringaresinol in Acanthopanax senticosus fermented strain extracts by HPLC
|
|
Strain ID |
Time (Day) |
EB (ppm) |
EE (ppm) |
Syringaresinol (ppm) |
|
2% extract |
LFFR20-001 |
3 |
29 |
147 |
24 |
|
5 |
22 |
97 |
32 |
|
LFFR20-002 |
3 |
25 |
117 |
23 |
|
5 |
22 |
86 |
34 |
|
LFFR20-011 |
3 |
25 |
115 |
22 |
|
5 |
19 |
72 |
49 |
|
LFFR20-012 |
3 |
27 |
125 |
20 |
|
5 |
19 |
79 |
49 |
|
LFF20-043 |
3 |
27 |
121 |
22 |
|
5 |
17 |
66 |
44 |
|
LFFR20-048 |
3 |
32 |
154 |
22 |
|
5 |
28 |
131 |
23 |
|
LFFR20-050 |
3 |
30 |
138 |
20 |
|
5 |
19 |
78 |
44 |
|
LFFR21-073 |
3 |
30 |
146 |
16 |
|
5 |
31 |
142 |
25 |
|
5% extract |
LFFR20-001 |
3 |
78 |
417 |
24 |
|
5 |
72 |
389 |
32 |
|
LFFR20-002 |
3 |
80 |
423 |
23 |
|
5 |
66 |
328 |
34 |
|
LFFR20-011 |
3 |
77 |
404 |
22 |
|
5 |
64 |
304 |
49 |
|
LFFR20-012 |
3 |
71 |
386 |
20 |
|
5 |
60 |
302 |
49 |
|
LFFR20-043 |
3 |
75 |
400 |
22 |
|
5 |
58 |
287 |
44 |
|
LFFR20-048 |
3 |
69 |
386 |
22 |
|
5 |
65 |
353 |
23 |
|
LFFR20-050 |
3 |
68 |
392 |
20 |
|
5 |
59 |
286 |
44 |
|
LFFR21-073 |
3 |
78 |
408 |
16 |
|
5 |
70 |
372 |
25 |
Download Excel Table
LFR20-011 균주의 경우, EB, EE 농도가 높음에도 불구하고 발효 기간이 3일에서 5일로 증가함에도 EE가 부분적으로 분해되어 낮은 SYR 농도가 측정되었다. 반면, LFR20-043 균주는 3일차에 생성된 EE를 효과적으로 분해하여 5일차에는 SYR의 농도가 증가하는 것을 확인할 수 있었다(Fig. 3). 이러한 결과는 β-glucosidase 효소의 작용에 의해 EB와 EE가 분해되어 SYR이 생성되었음을 시사하며, 특정 균주들은 가시오갈피 발효 중 SYR 생성을 촉진할 수 있음을 확인했다.
Fig. 3.
Quantitative HPLC analysis of syringaresinol in LAB-fermented Acanthopanax senticosus extract. (A) Standard chromatogram displaying reference peaks for Eleutheroside B, Eleutheroside E, and syringaresinol. (B, C) HPLC chromatograms of Acanthopanax senticosus extract after fermentation with Levilactobacillus brevis strain LFR20-011 for 3 and 5 days, respectively. The chromatogram from the third day demonstrates the presence of Eleutheroside E, which undergoes partial degradation by the fifth day, leading to a reduced syringaresinol peak, indicating a limited biotransformation efficiency within this fermentation period. (D, E) Comparative HPLC outputs for the strain LFR20-043 under analogous fermentative conditions. These results highlight a pronounced degradation of Eleutheroside E and a corresponding increase in syringaresinol concentration, evidencing a more effective enzymatic conversion by this particular strain.
Download Original Figure
4. Syringaresinol에 처리에 의한 MC3T3-E1 조골세포 증식에 미치는 영향
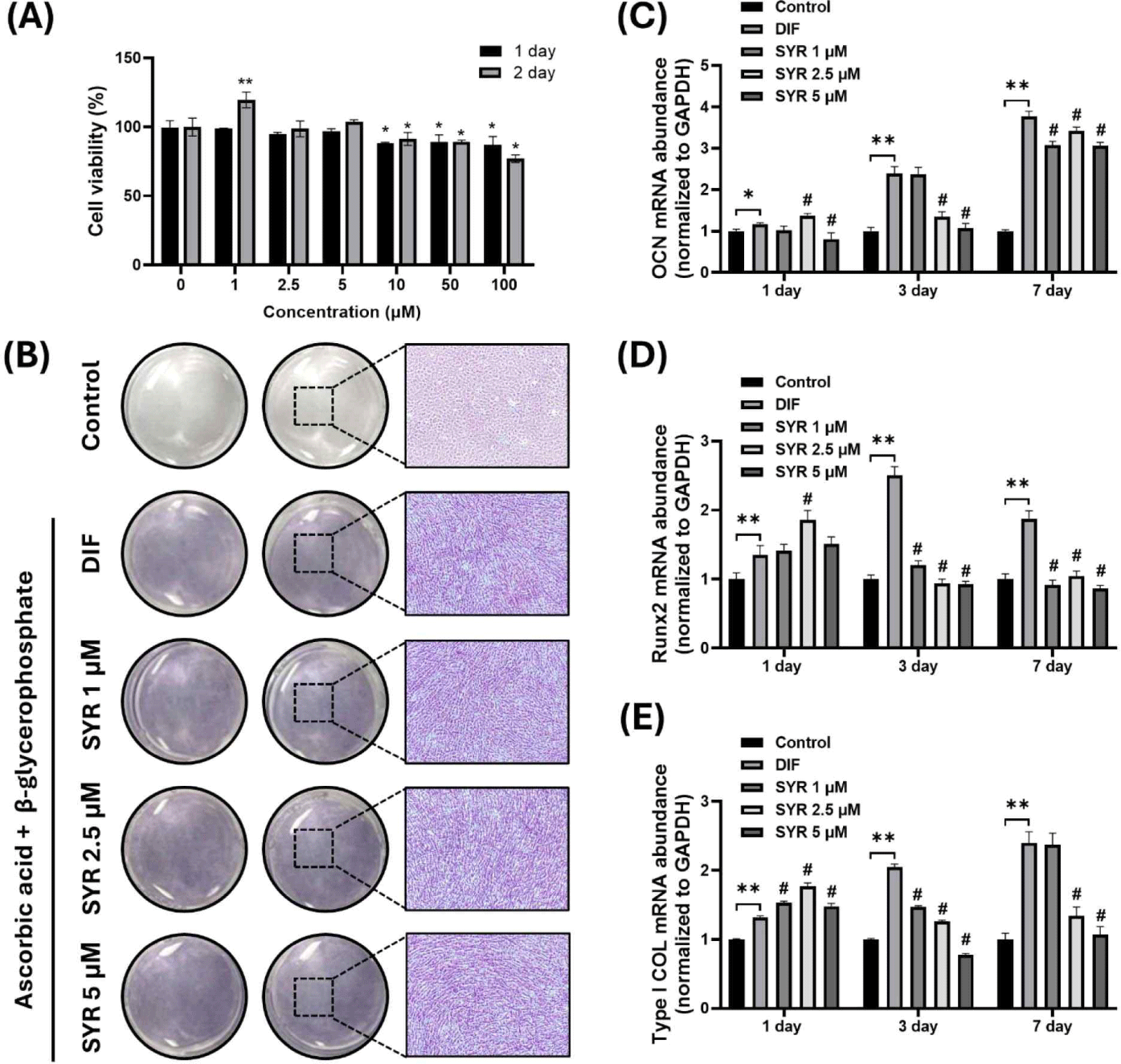
마우스 유래 조골세포주인 MC3T3-E1 세포에서 SYR의 세포 증식 및 독성 영향을 평가하기 위해 MTS 분석을 수행하였다. SYR은 1–100 μM 농도로 24시간 또는 48시간 처리한 결과, 1, 2.5, 5 μM 농도에서는 24시간과 48시간 모두에서 세포 독성이 관찰되지 않았으며, 특히 1 μM 농도에서는 48시간 처리 시 유의미한 세포 증식이 관찰되었다(Fig. 4A). 이에 따라 본 연구에서는 1, 2.5, 5 μM 세 가지 농도를 선택하여 MC3T3-E1 세포의 분화 영향을 추가적으로 조사하였다.
Fig. 4.
Effect of syringaresinol on MC3T3-E1 osteoblast differentiation. (A) Assessment of cell proliferation and toxicity of syringaresinol treated MC3T3-E1 osteoblast cells at concentrations of 1–100 μM for 24 and 48 h. (B) Alkaline phosphatase (ALP) staining demonstrating the effect of syringaresinol at 1, 2.5, and 5 μM on osteoblast differentiation after 7 days (ALP staining, ×4). (C–E) Quantitative analysis using real-time polymerase chain reaction (RT-qPCR) to measure mRNA levels of early differentiation marker Runx2, Type I collagen (COL), and mature differentiation marker osteocalcin (OCN) over days 1, 3, and 7. *p<0.05, **p<0.01 vs control, #p<0.01 vs DIF. DIF, differentiation.
Download Original Figure
5. 조골세포주 MC3T3-E1 분화과정에서 미치는 syringaresinol의 효능 평가
SYR 이 조골세포주 MC3T3-E1 분화에 미치는 영향을 평가하기 위하여, 분화 배지와 함께 SYR 을 1, 2.5, 5 μM 농도로 7일간 처리한 후 ALP 활성을 측정하였다. ALP staining 결과, 미분화 대조군(control)은 염색되지 않은 반면, 분화 유도 대조군(DIF, differentiation)은 ALP가 축적되어 진하게 염색되는 것을 확인할 수 있었다. 이와 유사하게 SYR 을 처리한 실험군에서도 1, 2.5, 5 μM 세 가지 농도에서 분화 유도 대조군(DIF)과 유사한 세포 형태와 진한 염색을 관찰함으로써 분화를 유도하는 것을 확인하였다(Fig. 4B).
분화 초기 마커인 Runx2와 Type I collagen(Type I COL) 및 후기(성숙) 분화 마커인 osteocalcin(OCN)의 mRNA 발현 수준을 RT-qPCR을 이용하여 조사하였다. 미분화 대조군(control)과 비교하였을 때, 분화 유도 대조군(DIF)에서는 1, 3, 7일 동안 OCN, Runx2, Type I COL mRNA의 발현이 유의적으로 증가하였다. Syringaresinol 처리한 실험군에서는 1일차에 분화 유도 대조군(DIF)과 비교하여 2.5 μM 농도에서 OCN과 Runx2 mRNA의 발현이 유의적으로 증가하였으며, Type I COL mRNA 발현은 세가지 농도 모두 유의적으로 증가하였다. 그러나 3, 7일차에서는 초기 분화 마커인 Runx2의 발현이 미분화 대조군(control) 수준으로 감소하였고, 후기 분화 과정에서 유도되는 Type I COL과 OCN mRNA 발현은 미분화 대조군(control)보다 증가하였으나, 분화 유도 대조군(DIF)보다는 유의적으로 낮은 수준으로 나타났다(Fig. 4C–E).
고 찰
본 연구는 대한민국 전통발효 식품인 김치에서 분리한 유산균에서 β-glucosidase 활성을 보이는 균주를 선별하고, 가시오갈피(A. senticosus) 추출물과 유산균 발효를 통해 bioconversion을 이용한 syringaresinol(SYR) 생성하는 과정에 초점을 맞추었다. SYR은 다양한 질병의 예방 및 치료 효능이 있는 것으로 알려져 있으며, 특히 본 연구에서는 SYR의 골 성장 치료 가능성을 연구하였다. 연구 결과, 특정 유산균 균주가 가시오갈피 발효 과정 중 SYR 생성을 유의적으로 증가시키는 것으로 나타났다. β-Glucosidase 활성이 EE, EB의 분해를 촉진하며, SYR의 생성량을 증가시키는 것을 확인할 수 있었다. 그러나, LFFR20-009, LFFR20-046 균주는 β-glucosidase 활성이 높게 나타났음에도 불구하고 SYR의 생성이 효과적으로 일어나지 않았다. 이러한 결과는 β-glucosidase는 기질 특이성에 따라 여러 그룹으로 분류된다. 효소의 종류나 공급원에 다른 기질에 대해 더 높은 특이성을 나타낼 수 있어 EE와 EB를 분해할 수 있지만 특정 균주에서 다른 기질에 대해 더 높은 특이성을 가질 수 있으며, 이로 인해 β-glucosidase 활성이 높음에도 불구하고 SYR의 생성이 효과적으로 일어나지 않을 수 있다[22,23]. HPLC 결과는 β-glucosidase가 있는 유산균을 이용한 bioconversion이 가시오갈피에서 syringaresinol을 효과적으로 생성하는 방법이 될 수 있음을 보여주며, 가시오갈피 발효를 통해 β-glucosidase 활성을 가진 특정 유산균을 사용하여 SYR을 합성하는 과정은 식물성 화학 물질이 생체 이용률과 효과를 향상할 수 있는 미생물 발효의 효과를 강조하는 이전 연구 결과와 일치한다. Morant et al.의 연구는 유산균이 장 건강을 촉진할 뿐만 아니라 다양한 물질을 생성하여 발효 스타터로 유용하며 유산균은 minor ginsenosides, γ-aminobutyric acid, equol 등 생물전환(bioconversion)할 수 있으며, glycoside 화합물이 생리 활성 대사물로 생물전환 하는데 중요한 역할을 한다는 것을 밝혔다[24].
고령인구의 뼈 건강을 위한 SYR의 새로운 기능성을 탐색하고자 했다. 뼈 형성과 흡수의 균형 유지는 건강한 뼈를 형성하는 데 필수적이며, 이는 조골세포와 파골세포 간의 직접적인 의사소통과 신호 전달을 통해 분화 촉진 또는 억제를 유도한다고 알려져 있다[25]. 세사민(sesamine)은 리그난계열의 구성원으로 식물성 에스트로겐 일종이다. 이는 Wnt/β-catenin및 NF-κB 신호 경로 조절하여 골형성을 촉진하고, 파골세포 성장을 억제하는 이중 기능적 역할을 한다고 보고되었다[26].
본 연구의 결과로 MC3T3-E1 조골세포의 분화 유도 과정에서 SYR이 초기 분화 과정에서는 분화 마커 mRNA의 발현을 증가시켜 분화를 촉진하지만, 이후 후기 분화 단계에서는 조골세포 분화를 억제하는 것으로 확인하였다. 이는 SYR이 골다공증에서 기능적 효능을 나타낼 수 있음을 시사하며, 파골세포에 대한 추가 연구가 필요함을 나타낸다.
본 연구의 결과는 향후 골다공증을 포함한 다양한 질병의 예방 및 치료에서 SYR을 활용하는 연구에 중요한 기초 자료이다. 그러나, 현재 연구는 β-glucosidase 활성을 가진 유산균 균주 분리 및 가시오갈피와의 발효 조건, SYR로의 전환에 대한 내용에 집중되어 있어 다양한 유산균 균주와 발효 환경에서의 SYR생산 가능성을 탐색할 필요가 있다. 또한, SYR의 생리적 효능 및 안전성을 평가하기 위한 연구도 필요하다. 이를 통해 SYR의 골다공증 예방 및 치료 효과에 대한 보다 명확한 기전을 규명하고, 생물전환 기술의 고도화 및 적용 가능성을 탐색하는 중요한 자료가 될 것으로 판단된다.
요 약
유산균이 가지고 있는 β-glucosidase활성이 가시오갈피(A. senticosus)의 주요 활성 성분인 EE와 EB와 같은 식물성 화합물을 분해하여 syringaresinol(SYR)로 전환하는 역할을 하는지 탐구하였다. 김치 등에서 분리배양한 유산균 125개 중, β-glucosidase 활성을 지닌 균주를 세포 외 및 내부에서 스크리닝된 것이 46종으로 확인되었으며, 특히 L. curvatus인 LFFR 20-011과 L. brevis인 LFFR 20-043 등이 가시오갈피 발효를 통해 SYR의 생산을 2배 이상 함량을 증가시키는 것을 확인할 수 있었다. 추가적으로, 본 연구는 SYR이 조골세포 분화에 미치는 영향을 조사하였다. SYR처리는 분화를 유도하고 조골세포 분화 초기 마커인 Runx2, Type I COL, 및 성숙 마커인 osteocalcin (OCN)의 mRNA 발현 수준을 유의미하게 증가시켰다. 이러한 결과는 생물전환기술로 증가된 한국가시오갈피의 SYR의 존재가 뼈의 건강과 성장에 긍정적인 영향을 줄 수 있는 잠재력을 가지고 있음을 시사하며, 향후 고령시대의 근골격계 건강 증진에 관한 연구로의 가능성을 제시하여, 한국가시오갈피의 유산균 발효물에 대한 건강기능식품으로써의 기초적인 자료를 제공한다.