서 론
우유는 어린 포유동물의 초기 성장단계에서 핵심적인 영양소 공급원이다. 인간을 제외한 모든 포유동물은 이유기가 끝나면 우유 섭취를 중단한다. 하지만 인간은 성인이 되어서도 우유뿐만 아니라 다양한 유제품을 통해 우유를 지속해서 마시게 된다. 우유는 탄수화물, 지방, 단백질, 비타민, 미네랄 등 다양한 영양소를 균형 있게 포함하고 있는 대표적인 식품이다[1]. 이러한 우유를 생산하고, 이를 통해 다양한 유제품을 생산하는 낙농산업은 축산산업의 가장 큰 비중을 차지하고 있는 분야이다. 하지만 최근 한국을 포함한 전 세계적으로 시장가격 변동성과 생산비용 증가, 식물성 우유 대체품의 등장 그리고 우유 소비량 감소로 인해 낙농산업은 어려움을 겪고 있다[2–4]. 우유와 유제품의 수익성 증대를 위한 새로운 방안 마련이 어느 때보다 요구되는 시점이다. 낙농산업 발전을 위해 지속적인 우유를 구매하는 소비자를 포함하여 우유 소화의 어려움을 가지고 있는 잠재적 소비자의 요구를 반영한 고객 맞춤형 우유를 생산하는 것이 중요할 것이다. 우유 섭취에 따른 소화 불편은 전 세계 성인 인구의 약 65% 수준에 해당한다고 알려져 있으며 이는 유당 흡수 장애와 관련이 있다[5,6]. 유당불내증이 있는 사람은 우유 섭취 후 소화불량, 복통, 복부 팽만감, 대변 빈도 증가 등의 소화기 증상을 겪는 것으로 알려져 있다[7]. 이는 우유 내 함유된 단백질이 소화되는 과정에서 발생하는 현상으로, 유제품 시장에 판매 중인 A1 유형 우유를 섭취하였을 때 나타날 수 있는 증상이라는 주장이 최근 여러 연구를 통해 보고되고 있다[8]. 우유의 단백질 중 약 80%를 차지하는 것이 casein이다. 우유의 casein은 α, β, κ-casein으로 구성되어 있으며, 그중 β-casein이 약 30%의 비중을 차지한다. 우유의 β-casein은 다양한 변종(A1, A2, A3, B, C, D, E, F, G, H1, H2, J)을 가지고 있으며, A1 유형과 A2 유형이 가장 흔히 나타나는 유형이다. 현재 판매되고 있는 대부분 우유는 A1 유형 β-casein을 함유하고 있는 A1 유형 우유로 이는 소화 과정에서 BCM7(β-casomorphin7)로 분해되는데 이 물질이 소화 장애를 유발하는 것으로 알려져 있다[9,10]. 최근 A1 유형 우유를 섭취하였을 때 나타나는 불편함을 해소하고자 출시된 제품인 A2 유형 우유는 A2 유형 β-casein만을 함유한 우유로 소화 과정에서 BCM7의 생성이 적어 우유 섭취로 인한 소화불량 증상이 개선된다는 점을 강조하며 시장을 형성하기 시작하고 있다. 뉴질랜드에서 처음으로 상업화된 A2 유형 우유는 전 세계 우유 시장에서 잘 팔리고 있으며, 새로운 고급유로 인식이 되어 낙농산업 발전을 위한 새로운 방안으로 인식되고 있다. 본 리뷰 논문에서는 A2 유형 우유의 시장성, 영양학적 특성 그리고 이미 알려진 기능성을 중심으로 정리를 하였다.
본 론
전 세계적으로 요거트와 치즈 같은 유제품 소비는 증가하고 있지만, 백색 시유인 우유의 소비는 점점 감소해 오고 있다. 특히 미국과 유럽 연합 같은 특정 지역에서는 1970년대 이후 우유 소비가 많이 감소했다. 유럽 연합(EU)의 보고에 따르면 1인당 우유 소비량은 매년 감소하여 2013년부터 2018년 사이에 2% 감소하였으며, 2018–2030년 동안에도 지속해서 감소가 될 것으로 예측한다. 낙농업계는 우유 소비량 증진을 위한 더 창의적이고 새로운 제품을 개발하기 위해 많은 노력을 기울이는 중이다. 2003년 A2 Milk Company Limited의 등장으로 A1 유형 β-casein이 없는 우유 제품과 관련 유제품이 시장에 알려지게 되었다. A2 유형 우유의 소화 개선 효과와 인체의 건강에 미치는 다양한 연구 결과들이 제시되면서 전 세계의 낙농업 종사자들 사이에서 잠재적 브랜드 가치가 높은 A2 유형 우유 생산으로 전환하려고 하는 추세이다[11]. 하지만 이러한 변화 속에서도 몇 가지 고려해야 할 사항들이 있다. 첫째 A1 혹은 A2 유형의 우유를 생산하는 젖소의 우유 생산량의 차이에 대한 논쟁이다. 일부 연구에서 A1 유형의 우유를 생산하는 젖소의 우유 생산량이 A2 유형에 비해 높다고 보고되었는데, 또 다른 연구들에서는 우유 생산량이 차이가 없다고 보고되어 A1과 A2 유형 우유를 생산하는 젖소의 유생산성에 대한 결과는 명확하지 않은 현실이다[12–14]. 둘째, 순수한 A2 유형의 우유를 생산하는 젖소를 선별해 검사해야 한다. 최근 유전자형 검사 비용이 적어지고 있기 때문에 큰 부담이 되지는 않을 것으로 보인다[15]. 셋째, A1과 A2 유형 우유는 분리 착유해 납유를 해야 한다. 젖소는 유형에 따라 별도로 착유되어야 하며, 독립적인 운송과정을 통해 A1 유형 우유 혼입을 단절해야 하는 시설적 문제가 있다. 이런 불편한 일들을 고려하고도 A2 유형의 우유를 생산하기 위해 A2 유형 우유의 상품성과 시장의 잠재적 가치 등을 고려하는 것이 필요할 것이다[15].
소비자의 소비 형태와 수요는 시대에 따라 급격하고 다양하게 변화해 왔다. 최근 소비자 수요는 식품의 양보다는 품질을 더 중요시하고 있으며 게다가 인간의 건강과 관련한 영양학적 측면에 많은 관심을 가지는 것으로 변화되었다. 유제품 소비 관련 설문조사에 따르면 우유 과민반응이 있는 소비자는 우유를 구매할 때 우유의 영양성분과 품질이 주요 고려 대상인 것으로 나타났다[16]. 사회 경제적 수준과 A2 유형 우유 인식 간에는 긍정적인 연관성이 있었으며, 고품질에 대한 인증과 건강과 관련된 항목이 표기된 경우에 A2 유형 우유 구매에 있어 소비자들의 긍정적인 반응이 있었다[16,17]. 최근 연구에 따르면 A1/A2 유형 우유와 관련된 연구 논문들의 수가 과거에 비해 증가하고 있다. 2020년과 2021년 동안 A1/A2 유형 β-casein과 관련된 내용의 연구 논문 출판이 정점에 도달했다. Grand View Research, Fortune Business Insights 및 IMARC Group의 보고에 따르면 전 세계 A2 유형 우유 시장 규모를 2021년 24억 4천만 달러, 2022년 114억 달러로 추정했다[18]. 세계시장에서 A2 유형 우유는 건강에 대한 소비자들의 관심과 더불어 유당불내증이 있는 사람들에게 대안 유제품으로 인식되면서 잠재적 시장 규모와 그 가치가 더 높을 것으로 전망된다. 하지만 이러한 우유 효능의 잠재성과 A2 유형 우유의 품질에 대한 연구 결과가 아직은 미비한 실정으로 추가로 연구가 진행되어야 할 것이다.
A1 유형 우유와 비교하여 A2 유형 우유의 품질, 색상 및 구성을 조사한 최근 연구에 따르면 유전자형의 차이가 우유의 냄새, 맛 또는 일반적인 수용도에는 영향을 미치지 않는 것으로 나타났으며, 우유의 색깔은 약간의 차이를 보인다는 연구 결과가 있는데 이는 A2 유형 우유가 소비자에게 더욱 매력적으로 작용한다고 보고되었다[19]. β-casein의 유전자 변이 차이에도 불구하고 우유의 품질 특성이 크게 차이를 보이지 않는 것은 우유 내 단백질, 지방, 유당 등 우유의 영양학적 성분 조성과 함량에서 큰 차이를 보이지 않기 때문으로 판단된다[19]. 하지만 우유의 주요 영양소 이외의 세부 영양소에서는 차이가 있는 것으로 알려져 있다. 다양한 포유류의 우유는 영양소 성분이 조금씩 다르지만, 주요 구성 영양소는 단백질, 지방과 일부 탄수화물이다. 우유 단백질은 약 80%가 casein으로 구성되어 있으며, 이는 αs1, αs2, β, κ casein으로 나뉘며, A1/A2 유형 우유의 차이는 casein 단백질에서 나타난다. β-casein은 13개의 변종을 가지고 있으며, 67번째 위치의 아미노산의 차이에 따라 A1 유형과 A2 유형의 두 변이체가 대표적이다. A1 유형은 67번째 위치에 histidine이 자리하고 있지만 A2 유형은 같은 위치에 proline으로 대체되어 있다[20]. 이러한 차이는 1차 단백질 소화에 영향을 미치며, 이는 A1 유형 우유가 소화 중에 생리활성 펩타이드인 BCM7을 생성한다는 것을 의미하며, 이는 opioid 수용체 활성과 연관이 있다[21]. BCM7은 면역체계를 손상시키고 당뇨병 위험의 증가와 심혈관계 질환에 영향을 주는 것으로 알려져 있다[22,23]. 이에 따라 단백질 소화 과정에서 BCM7의 생산이 적은 A2 유형 우유가 건강한 우유라는 인식과 함께 고급유로 주목받고 있다. 이외에도 아미노산과 지방, 칼슘의 수준에서 A1 유형과 A2 유형 우유의 차이가 보고된 바 있으며, 최근 연구에 따르면 A1 유형 우유는 histidine, lysine, isoleucine, methionine 및 valine의 함량이 높은 것으로 확인되었으며, A2 유형 우유는 leucine의 함량이 높다고 보고되었다. 또한 A2 유형 우유는 A1 유형 우유에 비해 β-lactoglobulin과 α-lactalbumin이 높다는 연구 결과가 보고되었다. 지방산의 경우 A2 유형 우유에서 포화지방산인 lauric acid, margaric acid, stearic acid의 함량이 A1 유형 우유에 비해 유의하게 높았으며, A1 유형 우유는 단일 불포화지방산의 함량이 A2 유형 우유에 비해 비교적 높은 것으로 보고되었다[19]. 총칼슘량에서는 A1 유형과 A2 유형 우유 간에 비슷한 함량을 포함하고 있는 것으로 보였지만 A2 유형 우유에서 유리 이온 칼슘이 높은 농도로 존재함이 확인되었다[24]. A1 유형과 A2 유형 우유의 대사산물을 분석한 최근 연구에 따르면 methionine, proline, α-lactose의 함량은 A2 유형 우유에서 높았으며, choline, glycine, citric acid 및 cAMP(cyclic adenosine monophosphate)의 함량은 A1 유형 우유에서 높게 나타났다[25,26]
다시 정리하면, A1 유형 우유와 A2 유형 우유는 주요 영양소 함량의 큰 차이는 없지만, 아미노산과 지방, 칼슘의 주요 성분에서는 약간의 차이가 있는 것으로 보인다. 하지만 다양한 요인에 의해 우유의 영양소 함량이 영향을 받는다는 것을 고려했을 때 A1과 A2 유형 우유의 영양성분 분석 결과 차이에 대한 데이터가 앞으로 축적되어야 A2 유형 우유의 영양학적 가치를 명확하게 규명할 수 있을 것으로 판단된다.
우유를 가공한 요거트, 치즈, 버터 등 다양한 유제품으로 판매해 상품 가치를 높임으로 원유가격의 부가가치를 상승시킬 수 있다. 기존의 ‘흰 우유’인 백색 시유의 소비량 감소와 유가공품의 소비 증가에 현대 음식 소비문화가 많은 영향을 미치는 것으로 알려져 있다. β-Casein 변성은 A1 유형과 A2 유형 우유의 응고 특성과 단백질에 큰 영향을 미친다는 연구가 다수 보고되었다. 산성 겔화는 산성 조건에서 우유 단백질이 응고되는 것을 말하며, 일반적으로 요구르트와 특정 유형의 치즈 생산에 사용된다. 연구에 따르면 β-casein의 다형성 구조, 특히 A1 유형 및 A2 유형 변성은 우유의 산성 겔화 작용에 상당한 영향을 미치는 것으로 나타났다. 특히, A2 유형 우유는 A1 유형 우유보다 탄성률, 보수력, 투과성이 더 낮았으며, 겔화가 진행되는 시간이 더 소요되는 것으로 보고되었다. 하지만 거품 형성의 측면에서 A1 유형 우유는 거품 형성 속도에서 우수하고, 반면에 A2 유형 우유는 거품의 풍부도와 지속 유지 시간 측면에서 우수하다고 보고되었다[25,27,28]. 치즈 생산 시 응유를 형성하기 위해 우유에 효소 rennet을 첨가하는 응고 과정이 포함된다. A1과 A2 유형 우유는 rennet 응고 특성에서 차이가 있음이 보고된 바 있는데, A1 유형 우유는 응고 시간, 응유 견고성, 단백질, casein 및 지방 함량에 긍정적인 영향을 미치지만, A2 유형 우유는 겔에서 다공성 미세구조와 미세한 단백질 가닥이 관찰되었으며, 치즈 제조 능력, 특히 응고 시간 및 응고 견고성 측면에서 부정적인 영향을 보였다[28,29]. 이는 β-casein 변종 유형에 따른 단백질, 칼슘과 지방의 구성에서 나타나는 차이에서 기인하는 것으로 보인다. 소비자 설문조사 결과에 따르면 A1 유형 또는 A2 유형 우유로 만든 치즈의 맛에 대한 차이는 느끼지 못했지만, 일부 A2 유형 우유로 만든 치즈에서 맛 차이를 느낄 수 있었다. A2 유형 우유로 만든 치즈는 A1 유형 우유로 만든 치즈와 비교해 보면 부드럽고 풍미는 더 느껴지지만, 조직의 일관성이 떨어지고 투박한 식감이라는 결과가 보고된 바 있다[30]. 다시 말해, A1과 A2 유형은 우유의 산 겔화와 rennet 응고에 따른 응유 등의 가공 특성에 큰 영향을 미치는 것으로 볼 수 있다. A2 유형 우유는 일반적인 유가공품으로의 생산성과 기술적 특성에서 A1 유형 우유에 비하여 부적합할 수 있다.
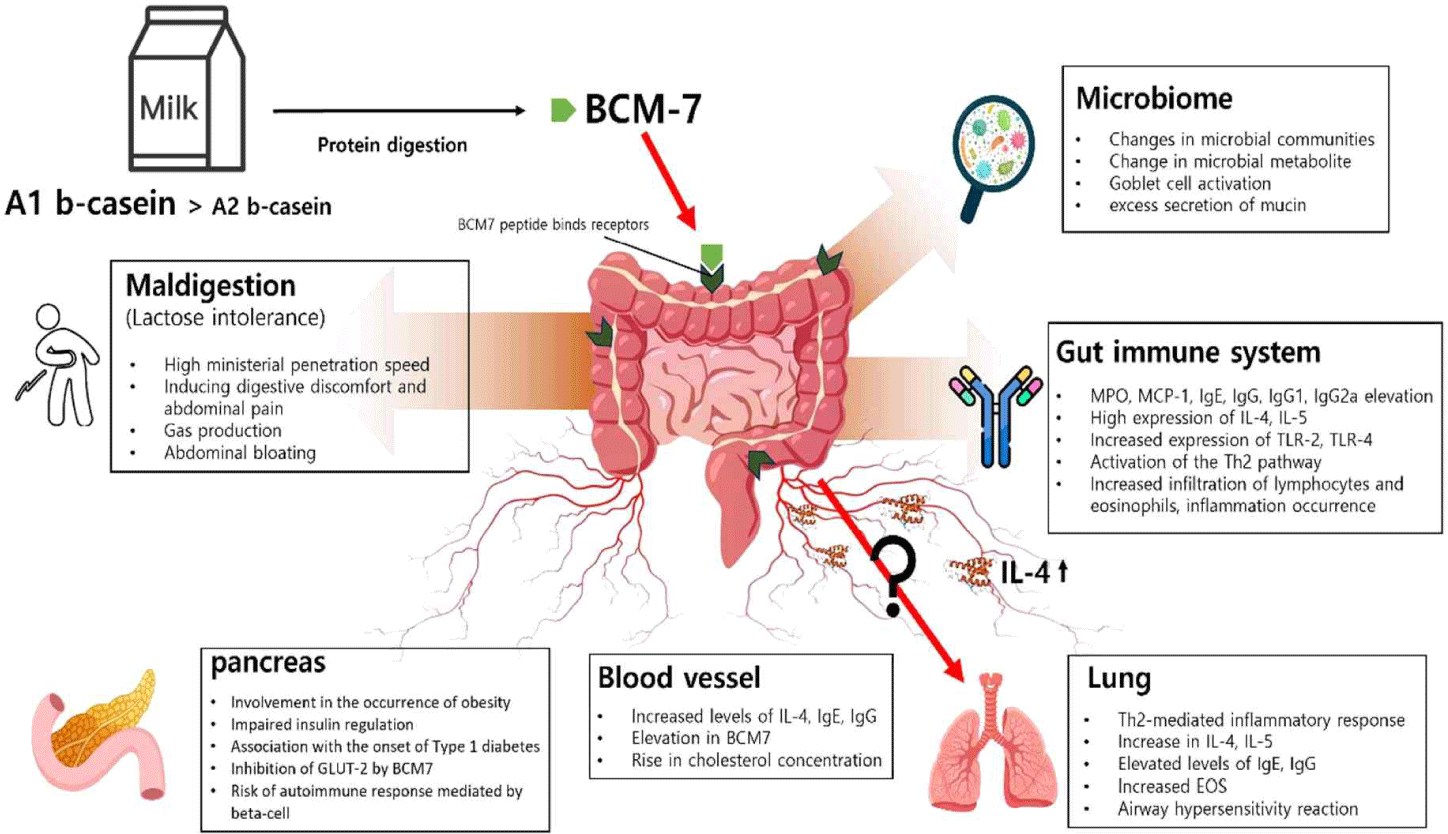
젖소의 우유에서 유당과 유단백질은 사람에게 에너지를 제공하는 대표적인 영양소이다. 유당은 우유의 주요 탄수화물이며 glucose와 galactose로 구성된 이당류이다. 소장 점막 표면에서 분비되는 lactase라고 칭해지는 β-galactosidase 효소에 의해 가수분해된다[31]. 사람은 이유 후 75%–90%의 lactase가 감소되기 때문에 유당 소화에 있어 어려움이 발생한다[32]. 유당 소화불량의 원인으로는 선천성 lactase 결핍, 유아 시기의 lactase 결핍, lactase 유전자의 다형성에 의해 발생하는 성인기 lactase 결핍, 질병으로 인한 이차 lactase 결핍 등이 알려져 있다. 유당불내증은 유당 섭취로 인하여 발생하는 장폐색, 그리고 소화과정 중에 발생하는 가스, 복부 팽만감, 그리고 경련, 설사 및 구토 등이 발생할 수 있다[33]. Casein은 사람의 위에서 응고되는 것으로 알려진 casein micelle 형태로 존재하는 반면, 유청 단백질은 가용성을 유지하여 소장으로 더 빠르게 전달된다[34]. Casein은 α, β, κ 형태로 유청 단백질은 α-lactalbumin, β-lactoglobulin, 그리고 lactoferrin으로 분해된다[35]. Casein과 β-lactoglobulin은 pepsin과 췌장 효소에 의하여 가수분해되며[36], 소화로 인해 생성되는 antimicrobial peptides, antioxidant peptides, opioid peptides, vasoactive peptides와 같은 peptide들이 인체 건강에 영향을 미친다[35]. In vitro 위장 소화기관 연구에서 A1 유형과 A2 유형 우유의 단백질 소화과정에서 발생하는 BCM7 생성이 β-casein 유형에 따라 차이가 있음이 밝혀졌다[37,38]. A1 유형과 A2 유형의 β-casein 유전자와 함께 67번째 아미노산 차이에 의해 BCM7의 생성이 결정된다. A1 유형 β-casein은 67번 아미노산 위치에 histidine이 위치해 있는 반면, A2 유형 β-casein에서는 proline이 위치하고 있다. 이러한 차이에 의해 파생되는 단백질 2차 구조의 차이는 casein micelle의 형성에 영향을 미칠 수 있다[39]. A1 유형 β-casein의 소화 산물로 생성된 BCM7은 우유 알레르기와 함께 소화기관 통과 시간 지연과 같은 소화 장애를 유발하는 원인으로 밝혀졌다[6]. BCM7은 opioid peptide의 한 종류로 위장관 내 통증 또는 갈증을 인지하는 μ-opioid 수용체와 결합하게 되고 이에 따라 일부 소비자들이 우유 섭취 후 불편함과 통증을 인지하게 된다. 하지만 이와 대조적으로 A2 유형 우유는 BCM7 생성에 따른 문제점이 발생하지 않을 뿐 아니라 항산화 활성과 glutathione의 자연 생성을 촉진한다. 결과적으로 A2 유형 우유는 A1 유형 우유와 비교하여 건강에 긍정적인 효과를 제공하며 안전성이 높은 제품으로 소비자들의 주목을 받고 있다[40].
장관 소화 속도의 증가는 복통 발생과 관계가 있다[41]. A1 유형 우유는 장관 투과 속도를 증가시키고 dipeptidylpeptidase-4 활성 증가와 MPO(myeloperoxidase)를 증가시키나, A2 유형 우유 섭취는 장 통과 속도와 MPO의 수치를 증가시키지 않는 것으로 보고되었다[42]. 중국에서 진행된 임상시험에서 A2 유형 우유는 A1 유형 우유에 비하여 유제품 섭취 시 발생하는 소화 어려움, 염증 지수, BCM7, 소화 장관 투과 속도 등을 감소시켰다[43]. 유당불내증 환자와 유당소화불량 환자들에게 A1 유형과 A2 유형 우유를 각각 급여하였을 때, A2 유형 우유 섭취는 유당불내증 환자에서 복통 지수 감소에 효과적이었다. 또한, 유당 소화불량 환자에서 질병 점수와 수소 생산량 감소 효과가 확인되었다[44]. 여성 유당불내증 환자에서도 A2 유형 우유는 수소 발생 감소와 동시에 매스꺼움과 대변 절박증 감소에 효과가 있었다[45]. 유아의 경우 어린이 분유 내 A2 유형 β-casein 첨가 효과를 확인하였는데, 12–36개월령 유아에게 일반 분유와 A2 유형 분유를 급여했을 때 변비와 경미한 장 스트레스를 가진 아이들의 장내 소화불량이 줄어들었다[46]. A2 유형 우유 섭취는 A1 유형 우유에 비하여 체내의 BCM7을 감소시키며 유제품 소화 불편 증상 완화 효과가 있었다.
장내 미생물군은 숙주와 함께 진화해 왔으며 인체의 필수적인 부분이라 할 수 있다. 장내 미생물은 유전적 환경적 요인에 의해서 변화하고 그 중 음식 섭취는 장내 미생물군 조성을 형성하는 데 가장 크게 영향을 미치는 요인이다[47]. 장내 미생물과 장내 미생물 유래 물질의 변화는 비만, 당뇨, 간질환, 심혈관계 질환 등의 다양한 대사질환 발병에 기여하므로 최근 많은 관심을 받고 있다[48]. 장내 미생물 조절에 대한 A1 유형과 A2 유형 우유의 효과를 확인한 동물실험 결과에 따르면 노화 마우스 모델에서 A2 우유 급여는 분변 내 단쇄지방산과 isobutyric acid, 장 상피 세포 내 CD4+와 CD19+ 세포, 그리고 장 융모 길이를 증가시켰다. 분변 미생물군 분석에서 A2 유형 우유를 섭취한 마우스 그룹에서 특이 미생물 균총으로는 Deferribacteriaceae와 Desulfovibrionaceae가 있으며, A1 유형 우유 섭취 그룹에서는 Ruminococcaceae가 가장 많은 것으로 나타났다[49]. A2 유형 우유를 섭취한 3주령 마우스에서는 소장 융모 길이, 혈중 내 IgE와 gG가 증가했고, Proteobacteria문, Clostridia강, Ruminococcaceae과 및 Lactobacillusanimalis종의 균총 증가로 장내 미생물의 구성과 다양성을 조절하는 효과가 있었다[50]. A1과 A2 유형 우유와 콩과 달걀 유래 단백질의 장내 미생물 조절 효과를 비교한 연구에서는 A1 유형 우유 급여 시 분변 내 acetate가 증가하였고, A1 유형과 A2 유형 우유 그룹 사이에서는 미생물 균총의 유의적인 차이는 없었다[51]. 이유기 이후 A1 유형 β-casein은 A2 유형 β-casein과 달리 동물의 맹장과 결장에서 Clostridium histolyticum종의 증가, 뇌의 μ-opioid 및 옥시토신 수용체의 변화와 함께 쥐의 스트레스로 인한 부동성을 많이 증가시켰다. 이는 이유 연령 이후 A1 유형 β-casein을 포함하는 우유를 섭취하면 장-뇌 축 메커니즘을 통해 기분이나 감정 형성 등에 영향을 미칠 수 있음을 시사한다[52]. BCM7은 장 배상세포의 직접적인 활성화와 μ-opioid 수용체 활성화를 통해 쥐의 mucin 생성을 증가시키는 것으로 나타났다. Mucin 생성이 과도할 경우 일부 경우 병원균에 의한 보호 장벽 기능의 붕괴 및 미생물 군집에 영향을 미칠 수 있다[53]. 정리하면 A2 유형 우유 섭취는 장내 미생물 조성 변화에 일부 영향을 미치며, 이는 장관 면역 유지에 도움을 줄 수 있음을 시사한다. 다만 현재까지 진행된 장내 미생물 실험도 대부분 마우스를 활용한 연구이므로 인간 장내 미생물을 대상으로 한 연구가 추가로 필요할 것이다.
A2 유형 우유 섭취와 인간의 건강 사이 상관관계에서 가장 많은 연구 부분 중 하나는 β-casein 단백질과 제1형 당뇨병 사이의 연관성에 대한 것이다. 자가면역질환인 제1형 당뇨병은 어린이에서 가장 흔한 만성 질환 중 하나이며, 전 세계적으로 발병률은 환경적 요인이 밀접하게 영향을 미친다는 결과가 있다[54]. Cavallo 등은 제1형 당뇨병에서 β-casein에 대한 항체가 증가한다는 것을 발표하였으며, casein 섭취가 당뇨병 발생에 영향을 미칠 수 있음을 시사하였다[55]. 실제로 비만이 아닌 당뇨병(NOD, non-obese diabetic) 마우스에게 우유를 급여한 동물실험 결과, A1 유형 β-casein이 당뇨병 발생을 증가시켰으나 A2 유형 β-casein은 발생시키지 않았다[56]. 당뇨병의 발병은 유아기 우유 섭취와 밀접한 연관성이 있을 것으로 이야기하곤 한다. 일부 연구 결과에서 보면 유아기 모유 수유와 젖소의 우유 단백질 섭취에 따른 제1형 당뇨병 발병의 민감성에 차이를 보여주었다. 이는 A1 유형 β-casein 젖소의 우유 단백질 섭취로부터 기인한 것으로 이는 β-세포의 자가 면역반응을 증가시켜 제1형 당뇨병을 유발하는 것으로 밝혀졌다[57]. A1 유형 우유와 제1형 당뇨병 발생 사이의 연관성에 대한 두 가지 기전이 제시된 바 있다. 첫 번째, BCM7의 opioid 작용에 기반한 메커니즘이다. BCM7의 opioid 활성으로 인한 대사 반응 중단은 인슐린의 조절 장애를 초래할 수 있으며, BCM7이 glutathione 농도를 감소시키는 등 포도당을 조절하는 메커니즘의 변화를 유도할 수 있다. 이는 opioid 수용체 억제제 투여 실험을 통해 증명되었다. 두 번째, β-casein 단백질과 β-세포에서 발견되는 포도당 수송체-2의 항원결정기의 분자 모방에 의한 것이다[58]. 그리고 약한 항산화 효소의 발현이 β-세포의 자가면역 반응을 더 높게 하여 제1형 당뇨병을 유발할 수 있다는 주장도 제기되었다[59]. 다음과 같은 A1 유형 β-casein 섭취와 제1형 당뇨병 발생 간의 상관관계를 보여주는 연구들이 일부 보고되었지만, 그 인과관계에 대한 증거는 매우 제한적인 실정이다. 또한 A1과 A2 유형 우유의 가수 분해물들의 처리가 당뇨 질환 마우스 모델에서 차이를 나타내지 않은 것과 같이[60], 상반된 연구 결과들도 많이 보고되어, 이에 대한 추가 연구가 필요할 것으로 보인다.
A2 유형 우유는 Th2 매개 염증 반응을 조절하는 효과를 나타낸다는 결과들이 보고되었다. 수컷 Swiss albino 쥐에서 A2 유형 우유의 급여는 장관에서 Th2 염증 반응 수치를 낮추는 결과가 보고되었다. 장관 내 MPO, ccl2(monocyte chemoattractant protein 1), Il-4, IgE와 IgG는 A1 유형 우유 섭취 시 상승했지만, A2 유형 우유 섭취 시 이와 같은 염증성 반응은 나타나지 않았다. 또한 A1 유형 우유는 소장 내 면역세포의 침투를 높여, TLR2와 TLR4와 같은 항원 인지 수용체 유전자의 발현을 유도하였다[61]. 장관 염증 조절 이외에도 A2 유형 우유 섭취는 폐 염증 반응 조절에 효과가 있음이 보고되었는데, A1 유형 우유를 먹인 쥐는 methacholine 농도가 증가함에 따라 기도 과반응성이 증가했으나, A2 유형 우유를 섭취한 쥐에서는 이와 같은 현상이 관찰되지 않았다[62]. 또한 앞서 언급한 장관 면역반응 조절 효과와 유사하게 A1 유형 우유 섭취는 Il-4 및 Il-5 반응을 기관지 폐포액 및 혈청에서 유도하였으나 A2 유형 우유 섭취는 그렇지 않았다. 또한 IgE 및 IgG 수준이 증가하고 림프구 및 호산구의 침윤이 증가하여 기관지 주변 염증이 A1 유형 우유 섭취 쥐에서 관찰되었다[62]. 유아를 대상으로 한 임상시험에서도 A2 유형 우유가 Th2 관련 염증 수치를 조절하는 것을 확인하였는데, 기존 우유를 섭취한 유아에서 혈청 Il-4, IgG, IgE, IgG1, BCM7 및 glutathione 수치가 기준치보다 많이 증가하였다[63]. A2 유형 우유 섭취는 Th2 기반 염증 반응을 저감하는 효능이 일부 보고된 바 있으므로, Type 2 염증 반응과 관련된 질병 발생을 조절할 가능성이 있는 것으로 보여 향후 관련 연구가 필요하다.
결 론
이 리뷰는 A1 유형 우유와 A2 유형 우유의 인체 건강에 미치는 영향을 종합적으로 검토하였다. 소화 개선, 장내 미생물 조절, 당뇨병 예방, 그리고 면역반응 조절 등 다양한 측면에서 A2 유형 우유가 유익한 영향을 나타냈다. 특히 A2 유형 우유의 소화 개선 효과와 면역 조절 능력은 건강에 긍정적인 영향을 줄 것으로 기대된다. 하지만, A2 유형 우유의 효능에 대한 정보는 몇 가지 임상시험 결과와 동물실험 결과에 의존하고 있어 그 효능과 기능에 대한 정보가 거의 잘 알려져 있지 않았다. 따라서 기존 A1 유형 우유와 비교하여 A2 유형 우유만의 차별성 있는 효능과 기능에 대한 연구결과가 요구된다. 더불어 섭취에 따라 나타나는 효과의 기전 연구가 진행될 필요가 있다. A2 유형 우유 연구 결과는 우유 소비에 관한 건강 정책 및 개인 건강 관리에 유용한 정보를 제공할 수 있다.
